
Одним из самых распространенных элементов на планете является алюминий. Физические и химические свойства алюминия используются в промышленности. Все, что нужно знать об этом металле, вы найдете в нашей статье.
Строение атома
Алюминий — 13-й элемент в таблице Менделеева. Это третий период, группа III, основная подгруппа.
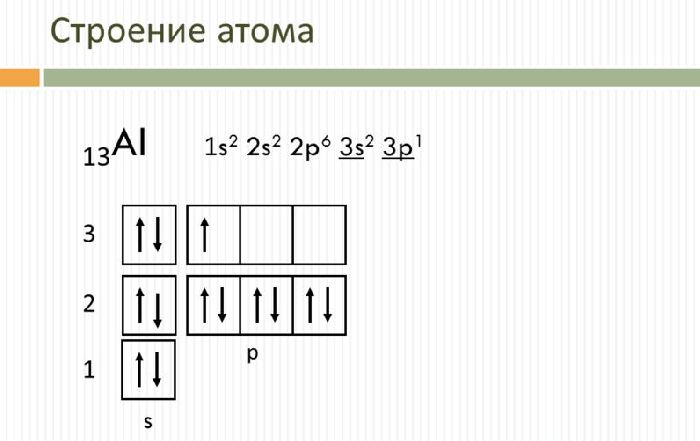
Свойства и применение алюминия связаны с его электронной структурой. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, расположенных на трех энергетических уровнях. Электронная конфигурация атома — 1s22s22p63s23p1.
Внешний энергетический уровень содержит три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбужденное состояние и способен отдать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Физическое описание
Алюминий имеет:
- легкость (плотность 2,7 г/см3);
- серебристо-серый цвет;
- высокая электропроводность;
- пластичность;
- пластичность;
- температура плавления – 658°С;
- температура кипения – 2518,8°С.
Из металла изготавливают жестяную тару, фольгу, проволоку и сплавы. Алюминий используется для производства микросхем, зеркал и композиционных материалов.

Алюминий – парамагнетик. Металл притягивается магнитом только в присутствии магнитного поля.
Химические свойства
На воздухе алюминий быстро окисляется и покрывается оксидной пленкой. Он защищает металл от коррозии, а также предотвращает взаимодействие с концентрированными кислотами (азотной, серной). Поэтому кислоты хранят и транспортируют в алюминиевой таре.
В обычных условиях реакции с алюминием возможны только после удаления оксидной пленки. Большинство реакций протекает при высоких температурах.
Важнейшие химические свойства элемента описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
С кислородом |
Горит при высоких температурах и выделяет тепло |
4Al + 3O2 → 2Al2O3 |
|
С неметаллом |
Реагирует с серой при температуре выше 200°С, с фосфором – при 500°С, с азотом – при 800°С, с углеродом – при 2000°С |
– 2Ал + 3С → Ал2С3; – Ал + П → АлП; – 2Ал + Н2 → 2АлН; – 4Al + 3C → Al4C3 |
|
С галогенами |
Реагирует при обычных условиях, с йодом — при нагревании в присутствии катализатора (воды) |
– 2Al + 3Cl2 → 2AlCl3; – 2Ал + 3И2 → 2АлИ3; – 2Ал + 3Бр2 → 2АлБр3 |
|
С кислотами |
Реагирует с разбавленными кислотами при нормальных условиях, с концентрированными кислотами при нагревании |
– 2Al + 3H2SO4(разбавленный) → Al2(SO4)3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
|
Со щелочами |
Реагирует с водными растворами щелочей и при плавлении |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
|
С оксидами |
Вытесняет менее активные металлы |
2Al + Fe2O3 → 2Fe + Al2O3 |
Алюминий не реагирует непосредственно с водородом. Реакция с водой возможна после снятия оксидной плёнки.

Что мы узнали?
Алюминий — амфотерный активный металл с постоянной валентностью. Он имеет низкую плотность, высокую электропроводность и пластичность. Притягивается магнитом только при наличии магнитного поля. Алюминий реагирует с кислородом и образует защитную пленку, предотвращающую реакции с водой, концентрированной азотной кислотой и серной кислотой. При нагревании реагирует с неметаллами и концентрированными кислотами, а при обычных условиях — с галогенами и разбавленными кислотами. В оксидах он вытесняет менее активные металлы. Не реагирует с водородом.








Комментирование закрыто