
Реакция кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно такие реакции протекают с выделением тепла.
Общее описание
Сущность нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуются новое вещество (соль) и нейтральная среда (вода).
Простой и понятный пример реакции нейтрализации – взаимодействие соляной кислоты с гидроксидом натрия:
Если окунуть лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, она станет фиолетовой, т е проявит нейтральную реакцию (красный – кислая среда, синий – щелочная среда). Раствор двух активных соединений превратился в воду за счет обмена натрия и хлора, поэтому ионное уравнение этой реакции выглядит следующим образом:
После нагревания полученного раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
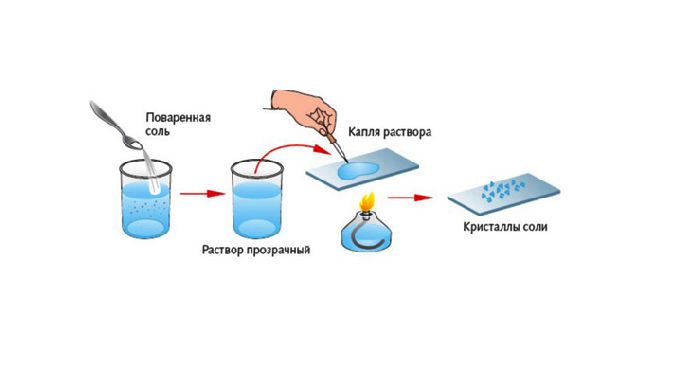
В подобных реакциях вода – обязательный продукт.
Примеры
Реакции нейтрализации могут протекать между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
- необратимые реакции – образовавшаяся соль не распадается на составляющие – кислоту и щелочь (они текут в одном направлении);
- обратимые реакции – образовавшиеся соединения способны разлагаться на исходные вещества и вновь взаимодействовать (текут в обоих направлениях).
Примером реакции первого типа является взаимодействие сильной кислоты и сильного основания:
- H2SO4 + 2KOH → K2SO4 + 2H2O;
- HNO3 + КОН → KNO3 + H2O.
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
- H2SO3 + 2NaOH ↔ Na2SO3 + 2H2O;
- Fe(OH)3 + H3PO4 ↔ FePO4 + 3H2O.
Слабые нерастворимые или малорастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроксид меди не растворяется в воде, но при реакции с азотной кислотой образует соль (нитрат меди) и воду:
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации являются основой титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например для определения кислотности желудочного сока, а также в фармакологии.

Кроме того, важно практическое применение нейтрализации в лаборатории: если разлилась кислота, ее можно нейтрализовать щелочью.
Что мы узнали?
Реакция, в которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любой кислотой и основанием: сильной кислотой и сильной щелочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция продолжается с выделением тепла. Нейтрализация используется в медицине и фармакологии.








Комментирование закрыто