
Сложные неорганические соединения, образующиеся из металлов и кислотных остатков, называются солями. Химические свойства солей позволяют получать различные соединения.
Виды
Общая формула солей
где M – металл, Ac – кислотный остаток, n и m – количество атомов металла и кислотного остатка соответственно.
По составу и образованию соли делятся на шесть типов:
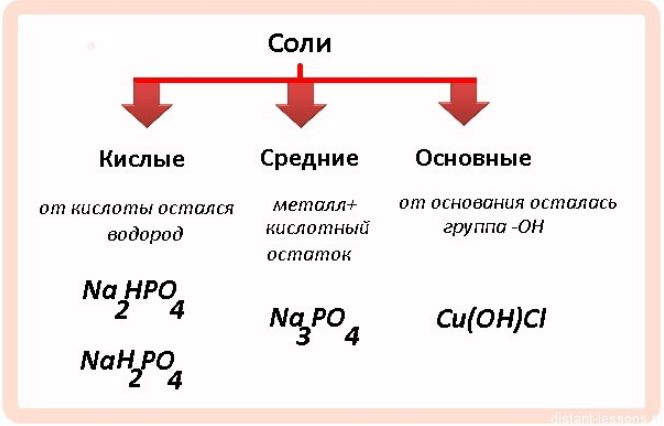
- средний (нормальный) – образуется при полном замещении водорода в кислоте атомами металлов или гидроксильной группы в основании кислотными остатками (Na3PO4 образуется из H3PO4, CuSO4 – из Cu(OH)2, AlCl3 – из HCl);
- кислые – образуются при неполном замещении водорода в кислотах атомами металлов (NaHSO4 образуется при присоединении Na к H2SO4, Na2HPO4 – от H3PO4);
- основные – образуются при неполной замене гидроксильных групп кислотными остатками (CaOHCl образуется из Ca(OH)2, FeOHCl2 – из Fe(OH)3);
- двойной – состоит из двух металлов и кислотного остатка (КNaSO4);
- смешанный – состоит из одного металла и нескольких кислотных остатков (CaClBr);
- комплексный – состоит из сложного аниона или катиона ([Cu(NH3)4]SO4).
Наиболее активными являются кислые соли, включающие водород. Химические свойства кислых солей сходны со свойствами кислот. Они взаимодействуют с металлами, их оксидами и гидроксидами, другими солями, щелочами.
Физические свойства
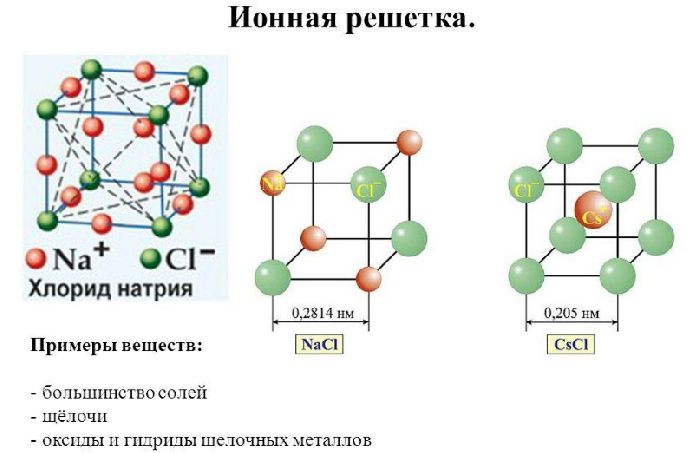
Соли – это кристаллические вещества разного цвета.
Основные физические свойства солей:
- ионная кристаллическая решетка;
- высокие температуры плавления;
- в твердом состоянии они плохо проводят электричество;
- по растворимости различают растворимые, малорастворимые и нерастворимые соли.
Некоторые соли имеют ковалентное или промежуточное, образованное ионными и ковалентными связями, строение.
Получение
Соли образуются из кислот и оснований. Реакции кислоты с разными веществами:
- с активными металлами –
2HCl + Zn → ZnCl2 + H2;
- с основными оксидами –
2HCl + CaO → CaCl2 + H2O;
- со щелочами –
HCl + NaOH → NaCl + H2O;
- с солями (выделяется газ или образуется осадок) –
Базы могут взаимодействовать:
- с неметаллами –
6KOH + 3S → K2SO3 + 2K2S + 3H2O;
- с кислотными оксидами –
2NaOH + CO2 → Na2CO3 + H2O;
- с солями (осаждение, выделение газа) –
2KOH + FeCl2 → Fe(OH)2 + 2KCl.
Есть и другие способы получить его:
- взаимодействие двух солей –
CuCl2 + Na2S → 2NaCl + CuS↓;
- реакция металлов и неметаллов –
Fe + S → FeS
- сочетание кислотных и основных оксидов –
SO3 + Na2O → Na2SO4;
- взаимодействие солей с металлами –
Fe + CuSO4 → FeSO4 + Cu.
Химические свойства
Растворимые соли являются электролитами и вступают в реакции диссоциации. При взаимодействии с водой они растворяются, т.е диссоциируют на положительно и отрицательно заряженные ионы – катионы и анионы соответственно. Катионы – ионы металлов, анионы – кислотные остатки. Примеры ионных уравнений:
- NaCl → Na+ + Cl−;
- Al2(SO4)3 -> 2Al3+ + 3SO42−;
- CaClBr → Ca2+ + Cl– + Br–.
Помимо катионов металлов, соли могут содержать катионы аммония (NH4+) и фосфония (PH4+).
Остальные реакции описаны в таблице химических свойств солей.
Реакция
Характеристики
Уравнение
С металлами
Более активный металл вытесняет менее активный
CuSO4 + Fe → Cu↓ + FeSO4
С кислотами
Характеристика солей, образованных более слабыми кислотами. Образуются новые соли
– Na2CO3 + 2HCl → 2NaCl + CO2 + H2O;
– FeOHCl + HCl → FeCl2 + H2O;
– Na2SO4 + H2SO4 → 2NaHSO4
Со щелочами
Соли, образующиеся из нерастворимых оснований, реагируют
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
С солями
Растворимые соли взаимодействуют. Образуется осадок
AgNO3 + NaCl → AgCl↓ + NaNO3

Рис. 3. Выделение осадка путем взаимодействия с основаниями. Некоторые соли в зависимости от вида разлагаются при нагревании на оксид металла и простые вещества. Например, СаСO3 → СаO + СО2, 2AgCl → Ag + Cl2.
Что мы узнали?
На уроке химии в 8 классе мы узнали о свойствах и видах солей. Сложные неорганические соединения состоят из металлов и кислотных остатков. Может включать водород (кислотные соли), два металла или два кислотных остатка. Это твердые кристаллические вещества, образующиеся в результате реакций кислот или щелочей с металлами. Реагирует с основаниями, кислотами, металлами и другими солями.
- с неметаллами –








Комментирование закрыто