
Определить активность простых веществ можно, воспользовавшись таблицей электроотрицательности химических элементов. Обозначается как х. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать электроны от других атомов называется электроотрицательностью. Эта концепция была впервые предложена Лайнусом Полингом в первой половине двадцатого века.
Все активные простые вещества можно разделить на две группы по своим физическим и химическим свойствам:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и имеют положительную степень окисления. Неметаллы могут проявлять восстановительные и окислительные свойства в зависимости от величины их электроотрицательности. Чем выше электроотрицательность, тем сильнее окислительные свойства.

Полинг создал шкалу электроотрицательности. По шкале Полинга наибольшая электроотрицательность имеет фтор (4), наименьшая — франций (0,7). Это означает, что фтор является сильнейшим окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он имеет тенденцию отдавать, а не принимать электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Способность элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. По шкале элементы со значением более двух окислителей обладают свойствами типичного неметалла.
|
Номер статьи |
Элемент |
Символ |
Электроотрицательность |
|
87 |
Франция |
Пт |
0,79 |
|
55 |
Цезий |
Cs |
0,79 |
|
19 |
Калий |
К |
0,82 |
|
37 |
Рубидий |
Рупий |
0,82 |
|
56 |
Барий |
Ба |
0,89 |
|
88 |
Радий |
Сырой |
0,9 |
|
одиннадцать |
Натрий |
Сейчас |
0,93 |
|
38 |
Стронций |
Старший |
0,95 |
|
3 |
Литий |
Ли |
0,98 |
|
20 |
Кальций |
О |
1.0 |
|
57 |
Лантан |
Позволять |
1.1 |
|
89 |
Актиний |
Переменный ток |
1.1 |
|
70 |
Иттербий |
Ыб |
1.1 |
|
58 |
Церий |
Се |
1.12 |
|
59 |
Празеодим |
Пер |
1.13 |
|
61 |
Прометей |
Вечера |
1.13 |
|
95 |
Америций |
Является |
1.13 |
|
60 |
Неодим |
Нд |
1.14 |
|
62 |
Самарий |
См |
1.17 |
|
64 |
Гадолиний |
Б-г |
1.2 |
|
66 |
Диспрозий |
Умереть |
1.22 |
|
39 |
Иттрий |
Да |
1.22 |
|
68 |
Эрбий |
Является |
1.24 |
|
69 |
Тулий |
Тм |
1,25 |
|
71 |
Лютеций |
Спать |
1,27 |
|
96 |
Курий |
См |
1,28 |
|
94 |
Плутоний |
Пух |
1,28 |
|
90 |
Торий |
Че |
1.3 |
|
97 |
Берклий |
Бк |
1.3 |
|
98 |
Калифорния |
См |
1.3 |
|
99 |
Эйнштейний |
Эс |
1.3 |
|
100 |
Фермий |
Фм |
1.3 |
|
101 |
Менделевий |
Доктор медицинских наук |
1.3 |
|
102 |
Нобелий |
Нет |
1.3 |
|
12 |
Магний |
Мг |
1.31 |
|
40 |
Цирконий |
Мистер |
1.33 |
|
93 |
Нептуний |
Например |
1,36 |
|
21 |
Скандий |
Наук |
1,36 |
|
92 |
Уран |
Ты |
1,38 |
|
73 |
Тантал |
Палец на ноге |
1,5 |
|
91 |
Протактиний |
На |
1,5 |
|
22 |
Титан |
Десять |
1,54 |
|
25 |
Марганец |
Мистер |
1,55 |
|
4 |
Бериллий |
Быть |
1,57 |
|
41 |
Ниобий |
Примечание |
1,6 |
|
1. 3 |
Алюминий |
Угорь |
1,61 |
|
81 |
Талия |
Тел |
1,62 |
|
тридцать |
Цинк |
Зн |
1,65 |
|
23 |
Ванадий |
В |
1,63 |
|
24 |
Хром |
Кр |
1,66 |
|
48 |
Кадмий |
CD |
1,69 |
|
49 |
Индий |
В |
1,78 |
|
31 |
Галлий |
Идти |
1,81 |
|
26 |
Железо |
Сказочный |
1,83 |
|
82 |
Вести |
Pb |
1,87 |
|
27 |
Кобальт |
Ко |
1,88 |
|
29 |
Медь |
Cu |
1,9 |
|
75 |
Рений |
Ре |
1,9 |
|
14 |
Кремний |
Сказать |
1,9 |
|
43 |
Технеций |
Тс |
1,9 |
|
28 |
Никель |
Девять |
1,91 |
|
47 |
Серебро |
Аг |
1,93 |
|
50 |
Банка |
Сн |
1,96 |
|
80 |
Меркурий |
Ртуть |
2 |
|
84 |
Полоний |
Пу |
2 |
|
83 |
Висмут |
Пчела |
2.02 |
|
5 |
Жизнь |
Б |
2.04 |
|
51 |
Сурьма |
Сб |
2.05 |
|
42 |
Молибден |
Мо |
2.16 |
|
33 |
Мышьяк |
Как |
2.18 |
|
15 |
Фосфор |
П |
2.19 |
|
1 |
Водород |
ЧАС |
2.2 |
|
77 |
Иридий |
ИК |
2.2 |
|
86 |
Радон |
Рн |
2.2 |
|
85 |
Астат |
На |
2.2 |
|
44 |
Рутений |
Грубый |
2.2 |
|
46 |
Палладий |
ПД |
2.2 |
|
76 |
Осмий |
Нас |
2.2 |
|
78 |
Платина |
Пт |
2.28 |
|
45 |
Родий |
Резус |
2.28 |
|
74 |
Вольфрам |
Вт |
2.36 |
|
79 |
Золото |
Ой |
2.54 |
|
6 |
Углерод |
С |
2,55 |
|
34 |
Селен |
Видеть |
2,55 |
|
16 |
Сера |
С |
2,58 |
|
54 |
Ксенон |
Ксе |
2.6 |
|
53 |
Йод |
Я |
2,66 |
|
36 |
Криптон |
НОК |
2,96 |
|
7 |
Азот |
Н |
3.04 |
|
17 |
Хлор |
Кл |
3.16 |
|
8 |
Кислород |
О |
3.44 |
|
9 |
Фтор |
Ф |
3,98 |
Вещества с электроотрицательностью два и менее являются восстановителями и обладают металлическими свойствами. Переходные металлы, имеющие переменные степени окисления и относящиеся к второстепенным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Элементы с электроотрицательностью, равной или меньше единицы, обладают выраженными восстановительными свойствами. Это типичные металлы.
В ряду электроотрицательности металлические и восстановительные свойства возрастают справа налево, а окислительные и неметаллические — слева направо.

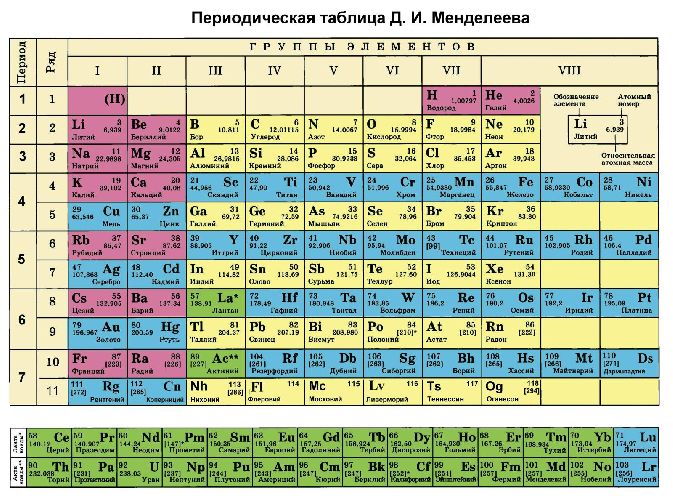
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Что мы узнали?
Электроотрицательность показывает способность элемента отдавать или принимать электроны. Это свойство помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у того или иного элемента. Для удобства Полинг разработал шкалу электроотрицательности. По шкале максимальными окислительными свойствами обладает фтор, минимальными — франций. В периодической таблице свойства металлов возрастают справа налево и сверху вниз.








Комментирование закрыто