
Соли – сложные вещества, обладающие рядом свойств и имеющие свою классификацию. Какие соли бывают и чем они отличаются друг от друга?
Классификация солей
Соли — продукты полного или частичного замещения атомов водорода в кислоте атомами металлов или продукты полного или частичного замещения гидроксильных групп основания кислотными остатками.
С точки зрения теории электролитической диссоциации соли — сильные электролиты, существующие в водных растворах в виде положительно заряженных ионов металлов (катионов) и отрицательно заряженных ионов кислотных остатков (анионов).
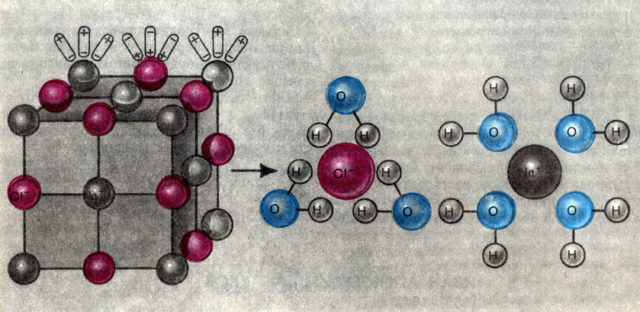
Диссоциация (ионизация) – обратимый процесс. Полнота ионизации зависит от природы электролита (соли и щелочи диссоциируют практически нацело), его концентрации (с увеличением концентрации ионизация идет труднее, равновесие сдвигается в сторону обратного процесса – моляризации, ассоциации), температуры (повышение температуры способствует диссоциации), природы растворителя (ионизация происходит только в полярном растворителе, в частности, в воде).
Соли классифицируют по составу с помощью следующей таблицы:
| кислый | средний | базовый | двойной | сложный |
| NaHCO 3 | К2SO4 | CuOHCl | КАl(SO4)2 | К3(Ал(ОН)6) |
|
(не все буквы H заменены) гидро+анион: бикарбонат натрия |
(в составе нет H и OH) анион: сульфат калия |
(не все ОН заменены) гидроксо+анион: гидроксохлорид меди |
(содержит различные металлы или, реже, кислотные остатки) сульфат алюминия и калия |
(содержит комплексный анион или катион) гексагидроксиалюминат калия |
Химические свойства солей
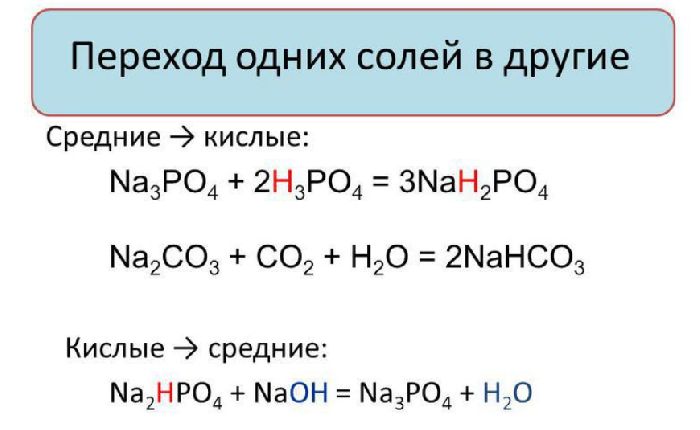
Одним из основных свойств солей является взаимный переход кислых, средних и основных солей. Вы можете перейти от кислой соли к нейтральной соли или затем к основной соли и обратно, используя реакцию нейтрализации, добавляя сначала к раствору щелочь, а затем кислоту. В реакции нейтрализации в зависимости от соотношения реагентов образуется кислая, основная или промежуточная соль.
Одним из свойств солей является гидролиз. Гидролиз солей, образованных слабой кислотой и сильным основанием или сильной кислотой и слабым основанием, обычно происходит только на первой стадии. Гидролиз солей, образованных слабой кислотой и слабым основанием, протекает до завершения.
Гидролиз солей – это реакция между некоторыми солями и водой, приводящая к образованию слабого электролита.
Так, соли, образовавшиеся из сильной кислоты и сильного основания (например, NaCl – поваренная соль), не подвергаются гидролизу. Соли, образовавшиеся из сильной кислоты и слабого основания, подвергаются гидролизу. Соли, образовавшиеся из слабой кислоты и сильного основания, подвергаются гидролизу. Их водные растворы имеют щелочную реакцию. Наиболее полному гидролизу подвержены хорошо растворимые соли, образованные слабой кислотой и слабым основанием.
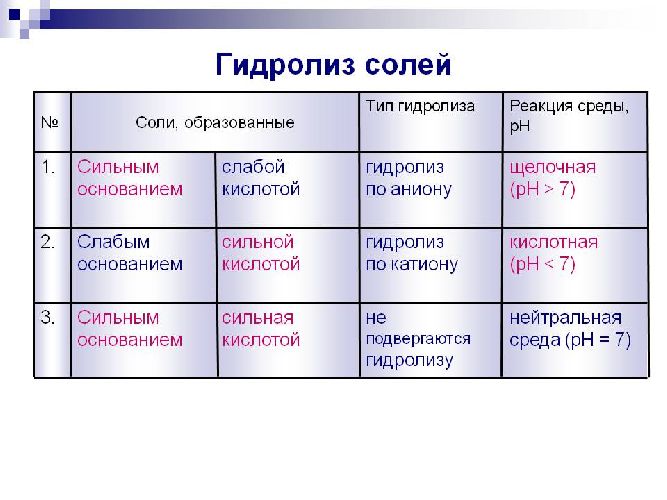
Нерастворимые соли гидролизу не подвергаются.
Многие соли подвержены термическому разложению. Все соли угольной кислоты при нагревании расщепляются, кроме соды и поташа. Соли фосфорной кислоты, кремниевой кислоты, уксусной кислоты, сероводородной кислоты и почти все соли соляной кислоты термически устойчивы. Сульфаты и гидросульфаты щелочных металлов не разлагаются. А, например, соли азотной кислоты расщепляются по-разному, в зависимости от расположения металла, катион которого входит в состав соли.
Что мы узнали?
В этой статье по химии (8 класс) представлено краткое описание общих химических свойств солей. Соли бывают кислые, средние, основные, двойные, комплексные. Каждый тип имеет ряд характеристик и функций.








Комментирование закрыто