
Алкены – более активный класс веществ, чем алканы. Химические свойства алкенов определяются строением их молекул.
Строение
Ненасыщенные углеводороды — алкены или олефины — отличаются от других классов органических веществ наличием двойной или π-связи между атомами углерода. Двойная связь может располагаться в любом месте молекулы.
Пи-связь образуется путем перекрывания p-орбиталей. Поскольку р-орбиталь имеет расширения в обе стороны от оси и напоминает гантель, пи-связь возникает в двух местах. В отличие от σ-связи, которая возникает при перекрытии s-орбиталей в форме шара, π-связь менее прочна и легко разрывается другими соединениями. Это определяет активность алкенов.
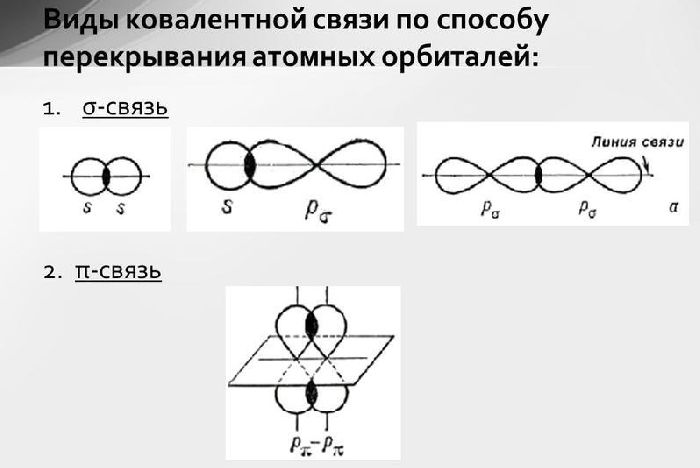
Двойная связь в реакциях присоединения выступает в роли донора электронов. Поэтому алкенам свойственны реакции электрофильного присоединения.
Физические свойства
Общие физические свойства алкенов:
- температуры плавления и кипения повышаются с увеличением молекулярной массы в гомологическом ряду;
- не растворяется в воде;
- прилипают к поверхности воды, поскольку их плотность во много раз меньше плотности воды;
- растворяется в органических растворителях — спиртах, эфирах.
Агрегатное состояние веществ меняется от количества атомов углерода в гомологическом ряду. Алкены с 2-4 атомами углерода – газы. От пептена (C5H10) до гептадецена (C17H34) вещества находятся в жидком состоянии. Алкены, содержащие более 17 атомов углерода, являются твёрдыми телами.

Химические свойства
Функции и примеры химических свойств алкенов приведены в таблице.
|
Реакция |
Описание |
Уравнения реакций |
|
Гидрирование — добавление водорода |
Он происходит при высоком давлении в присутствии катализатора – никеля, палладия или платины. Алканы – предельные углеводороды – образуются |
СН2=СН-СН3 + Н2 → СН3-СН2-СН3 |
|
Галогенирование — добавление галогенов |
Встречается в нормальных условиях. Галогены присоединяются через двойную связь. Дигалогеналканы образуются |
– CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl (1,2-дихлорэтан); – CH3-CH=CH-CH3 + Br2 → CH3-CH-Br-CH-Br-CH3 (2,3-дибромбутан) |
|
Гидрогалогенирование — добавление галогеноводородов |
Реакция электрофильного присоединения. Электрофил – это протон водорода в галогене. Галоалканы образуются |
CH2=CH2 + HCl → CH3-CH2-Cl (хлорэтан) |
|
Гидратация – добавление воды |
Реакция протекает в присутствии неорганических кислот — серной и фосфорной. Они действуют как катализатор и являются источниками водорода. Образуются одноатомные спирты |
СН2=СН2 + Н2О → СН3-СН2ОН |
|
Полимеризация – увеличение количества атомов |
Происходит в присутствии катализатора при повышенном давлении и температуре. Таким способом получают полиэтилен, поливинилхлорид, полипропилен |
nCH2=CH2 -> (-CH2-CH2-)n |
|
Горение |
Возникает при избытке кислорода |
CH2=CH2 + 3O2 → 2CO2 + H2O |
|
Неполное окисление |
Происходит в присутствии катализатора. Алкен, смешанный с кислородом, пропускают над нагретым серебром. Эпоксид – образуется оксид алкена |
2CH2=CH2 + O2 -> 2CH2-O-CH2 |
|
Реакция Вагнера |
Окисление перманганатом калия в щелочной или нейтральной среде. Спирты образуются |
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2KOH + 2MnO2 |
|
Окисление кипящим перманганатом калия в кислой среде |
Карбоновые кислоты образуются |
СН3-СН=СН-СН3 + 4[О] → 2СН3СООН |
При нагревании в присутствии катализатора алкены вступают в реакцию изомеризации. Меняется положение двойной связи или структура углеродного скелета. Например, бутен-1 (положение двойной связи между первым и вторым атомами) превращается в бутен-2 (двойная связь «сдвигается» на второй атом).

Что мы узнали?
На уроке химии в 10 классе мы узнали о химических свойствах алкенов. Двойная связь делает эти вещества более активными, чем алканы. Алкены взаимодействуют с галогенами, кислородом, водой, водородом и галогеноводородами. Большинство реакций протекает в присутствии катализатора при высокой температуре или повышенном давлении. Алкены образуют полимеры. Изомеры образуются также под воздействием катализаторов.








Комментирование закрыто