
Алкины – соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.
Строение алканов
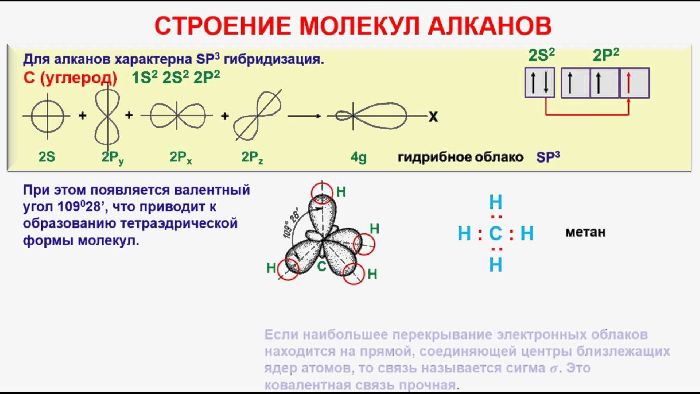
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовую (-СН2-) и метильную (-СН3) группы. Углерод может образовывать четыре неполярные ковалентные связи с соседними атомами. Именно наличие прочных σ-связей -CC- и -CH определяет инертность гомологического ряда алканов.
Соединения реагируют под воздействием света или тепла. Реакции протекают по цепному механизму (свободные радикалы). Таким образом, связи могут быть разрушены только свободными радикалами. В результате замещения водорода образуются галогеналканы, соли и циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
|
Виды химических реакций |
Описание |
Уравнение |
|
Галогенирование |
Реагирует с F2, Cl2, Br2. Реакции с йодом нет. Галогены заменяют атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°С. В результате образуются галогеналканы |
CH4 + Cl2 → CH3Cl + HCl |
|
Нитрование (реакция Коновалова) |
Взаимодействие с разбавленной азотной кислотой при температуре 140°С. Атом водорода заменен нитрогруппой NO2. В результате образуются нитроалканы |
CH3-CH3 +HNO3 → CH3-CH2-NO2 + H2O |
|
Сульфохлорирование |
Сопровождается окислением с образованием алкансульфонилхлоридов |
RH + SO2 + Cl2 → R-SO3Cl + HCl |
|
Сульфоксидирование |
Образование алкансульфокислот в избытке кислорода. Атом водорода заменен на группу SO3H |
C5H12 + HOSO3H → C5H11SO3H + H2O |
|
Трещины |
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей CC образуются алканы и алкены |
C4H10 → C2H6 + C2H4 |
|
Горение |
При избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа и сажи |
– СН4 + 2О2 → СО2 + 2Н2О; – 2CH4 + 3O2 → 2CO + 4H2O |
|
Каталитическое окисление |
Частичное окисление алканов происходит при низких температурах и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты |
C4H10 → 2CH3COOH + H2O |
|
Дегидрирование |
Удаление водорода в результате разрыва связей CH в присутствии катализатора (платина, оксид алюминия, оксид хрома) при температуре 400-600°С. Алкены образуются |
C2H6 → C2H4 + H2 |
|
Ароматизация |
Реакция дегидрирования с образованием циклоалканов |
C6H14 -> C6H6 + 4H2 |
|
Изомеризация |
Образование изомеров под воздействием температуры и катализаторов |
C5H12 -> СН3-СН(СН3)-СН2-СН3 |
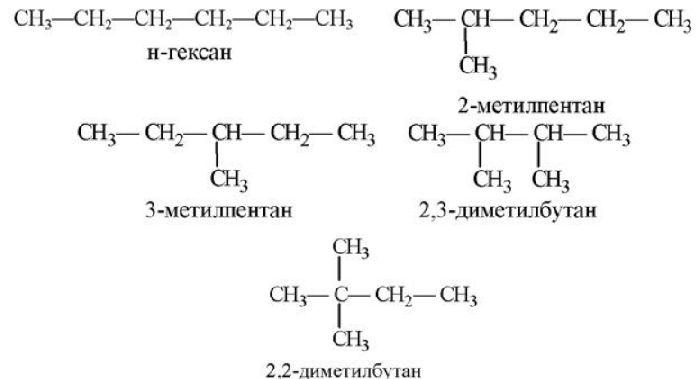
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.
Применение
Алканы широко используются в промышленной химии, косметике и строительстве. Составы состоят из:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- керосин;
- мыло;
- лак;
- краска;
- эмали;
- спирты;
- синтетические вещества;
- резина;
- сумматор прячется;
- пластик;
- моющие средства;
- кислоты;
- пропелленты;
- косметические инструменты.

Что мы узнали?
Изучили химические свойства и применение алканов. Благодаря прочным ковалентным связям между атомами углерода, а также между атомами углерода и водорода алканы инертны. Реакции замещения и разложения возможны в присутствии катализатора при высоких температурах. Алканы относятся к предельным углеводородам, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств и органических соединений.








Комментирование закрыто