
Между атомами водорода и атомом элемента с высокой электроотрицательностью возникает особый вид связи – водородная химическая связь. Он может образовываться не только внутри молекулы, но и между соседними молекулами.
Общее описание
Электроотрицательность — это способность атома удерживать валентные электроны на внешнем энергетическом уровне или количественная характеристика, показывающая, насколько сильно электроны притягиваются к ядру атома. Наиболее электроотрицательными элементами являются фтор, азот и кислород.

Сильное электростатическое взаимодействие между атомом водорода и электроотрицательными атомами обусловлено малым размером атома водорода и притяжением атомов элементов. В результате возникает частный случай полярной ковалентной связи. Примерами химических водородных связей являются:
- плавиковая кислота (HF);
- вода (H2O);
- аммиак (NH3);
- соляная кислота (HCl);
- сероводород (H2S).
Наличие водородной связи определяет физические и химические свойства вещества. В частности, он определяет температуру плавления, температуру кипения, растворимость и кислотность.
Особенностью связи является её невысокая прочность и распространённость, особенно в органических веществах.
Типы
Существует два типа водородных связей:
- межмолекулярный, возникающий между несколькими однотипными молекулами;
- внутримолекулярный, происходящий внутри одной молекулы.
Способ образования связи одинаков в обоих типах. Разница лишь в том, что с помощью межмолекулярной водородной связи образуется цепочка молекул, а с помощью внутримолекулярной связи водород «связывается» с атомами внутри молекулы.
Например, молекула воды состоит из одного атома кислорода и двух атомов водорода. Из-за своей высокой электроотрицательности кислород, имеющий шесть электронов на внешнем энергетическом уровне, притягивает единственные электроны от двух атомов водорода. Две пары электронов кислорода остаются свободными. При этом водородная орбиталь освобождается. Другая подобная молекула может присоединиться вместо свободных электронных пар к атому кислорода, заполняя вакантную водородную орбиталь. Возникает межмолекулярная водородная связь.

Молекулы плавиковой кислоты и аммиака соединяются аналогичным образом. Однако связь между азотом и водородом будет слабее, чем между водородом и кислородом. Более того, молекулы плавиковой кислоты притягиваются друг к другу сильнее, чем молекулы воды. Это объясняется величиной электроотрицательности.
Внутримолекулярные водородные связи возникают чаще всего внутри сложных молекул органических веществ — белков, ДНК, аренов. Например, в молекуле салициловой кислоты образуется водородная связь между атомом водорода в гидроксильной группе и атомом кислорода, входящим в функциональную группу -СООН.
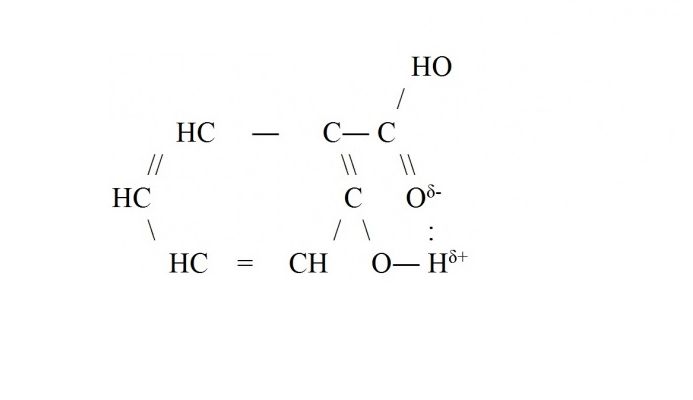
Водородные связи графически изображаются точками.
Что мы узнали?
Водородная связь возникает между атомами водорода и атомами неметаллов и основана на электростатическом взаимодействии между атомами. Это частный случай полярной ковалентной связи, характеризующийся взаимодействием водорода с атомами с высокой электроотрицательностью. Существует два типа связей: межмолекулярные, возникающие между молекулами вещества, и внутримолекулярные, возникающие между водородом и атомом другого элемента в той же молекуле. Водородная связь присуща неорганическим и органическим веществам.








Комментирование закрыто