
Металлы, которые легко реагируют, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов в таблице Менделеева уменьшаются слева направо. Поэтому наиболее активными считаются элементы I и II групп.
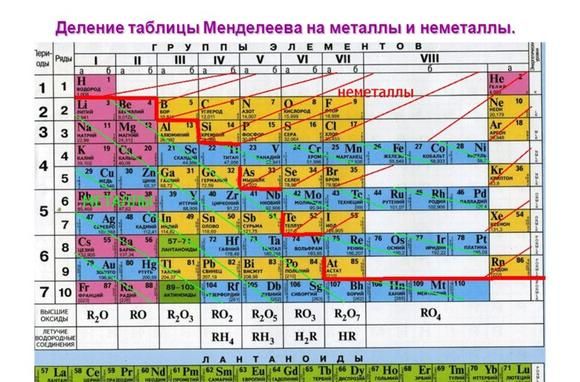
Все металлы являются восстановителями и легко отделяются электронами на внешнем энергетическом уровне. Активные металлы имеют только один или два валентных электрона. При этом металлические свойства возрастают сверху вниз с увеличением числа энергетических уровней, т к чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Щелочные металлы считаются наиболее активными:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- французский
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Степень активности металла можно определить по электрохимическому ряду напряжений металла. Чем левее водорода находится элемент, тем он более активен. Металлы справа от водорода неактивны и могут реагировать только с концентрированными кислотами.

К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы мягкие (можно резать ножом), легкие и имеют низкую температуру плавления.
Важнейшие химические свойства металлов представлены в таблице.
|
Реакция |
Уравнение |
Исключение |
|
Щелочные металлы самовоспламеняются на воздухе при взаимодействии с кислородом |
К + О2 → КО2 |
Литий реагирует с кислородом только при высоких температурах |
|
Щелочноземельные металлы и алюминий образуют на воздухе оксидные пленки и самовозгораются при нагревании |
2Ca + O2 → 2CaO |
|
|
Реагирует с простыми веществами с образованием солей |
– Са + Br2 → CaBr2; |
Алюминий не реагирует с водородом |
|
Интенсивно Реагирует с водой с образованием щелочей и водорода |
– 2Na + 2H2O → 2NaOH + H2; |
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной пленки |
|
Реагирует с кислотами с образованием солей |
– Са + 2HCl → CaCl2 + H2; – 2К + 2HMnO4 → 2KMnO4 + H2 |
|
|
Взаимодействуют с растворами солей, сначала реагируют с водой, а затем с солью |
2Na + CuCl2 + 2H2O: – 2Na + 2H2O → 2NaOH + H2; |
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность определяется строением атома – несколько электронов легко отрываются от внешнего энергетического уровня. Это мягкие легкие металлы, которые быстро реагируют с простыми и сложными веществами, образуя оксиды, гидроксиды и соли. Алюминий ближе к водороду, и его реакция с веществами требует дополнительных условий – высоких температур, разрушения оксидной пленки.








Комментирование закрыто