
Органические вещества способны образовывать изомеры. Это соединения с одинаковым количеством атомов, но разными по строению или расположению в пространстве. Строение и положение молекулы влияют на физические и химические свойства органических соединений.
Классификация и номенклатура
Объяснение изомерии было достигнуто во второй половине XIX века благодаря теории химического строения органических веществ Александра Бутлерова. Химик показал, что свойства веществ зависят не только от количества атомов, но и от их расположения в молекуле и пространстве.

В связи с этим выделяют два типа изомерии:
- структурные – связанные с положением атомов или групп атомов в молекуле вещества, а также с положением нескольких связей;
- пространственный – отражает положение молекулы в пространстве относительно условной плоскости.
Количество изомеров одного вещества зависит от количества атомов углерода в молекуле. Чем длиннее цепь, тем больше вариантов изомерии.
Структурная
Положение заместителя, двойных связей и функциональной группы в молекуле может быть изменено. В связи с этим выделяют следующие виды структурной изомерии:
- углеродный скелет;
- положения.
Изомерия углеродного скелета предполагает перенос метильной группы -СН2 на любой атом углерода в молекуле. Например, одна группа СН2 может оторваться от пентана (СН3-СН2-СН2-СН2-СН3) и присоединиться ко второму атому, образуя 2-метилбутан.
Позиционная изомерия бывает трех типов:
- кратные связи – изомеры образуются за счет движения кратных связей в молекуле: СН2=С=СН-СН3 (бутадиен-1,2) и СН2=СН-СН=СН2 (бутадиен-1,3);
- функциональная группа – изменение положения функционального радикала: СН3-СН2-СН2-СН2ОН (бутанол-1) и СН3-СН2-СНОН-СН3 (бутанол-2);
- заместитель – присоединение радикала к другому атому углерода в молекуле: CH3-CHCl-CH2-CH3 (2-хлорбутан) и CH2Cl-CH2-CH2-CH3 (1-хлорбутан).
Отдельно выделяют классовую изомерию, которая в основном зависит от положения функциональной группы. В некоторых случаях при перемещении атома, например от конца молекулы к центру, образуется вещество другого класса. При этом молекулярная формула веществ остается прежней. Например, CH3-CH2-OH – это этанол, а CH3-O-CH3 – диметиловый эфир. Молекулярная формула обоих веществ C2H6O. Другой пример: пропилен и циклопропан формулы C3H6.
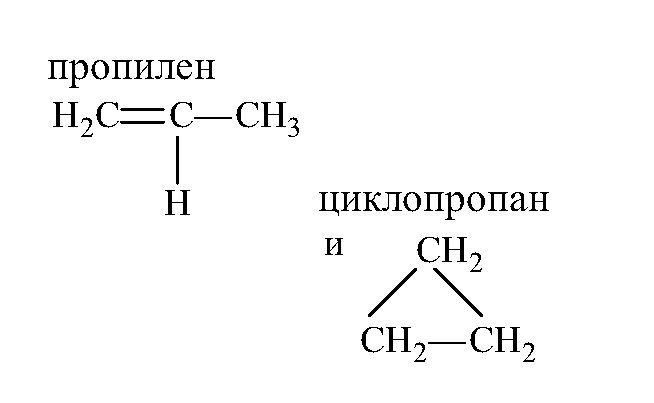
Наименование структурных изомеров складывается из названий радикалов и углеродной цепи. В начале названия ставятся цифры, обозначающие номер атома, к которому прикреплён радикал (отсчёт начинается с разветвлённого конца). Также могут ставиться цифры в конце названия, обозначающие номер атома с двойной или тройной связью.
Пространственная
Этот тип делится на две группы:
- оптическая или зеркальная изомерия;
- геометрическая изомерия.
Суть оптической изомерии заключается в зеркальном отражении молекул. Изомеры, по-видимому, отражают друг друга.
Геометрическая изомерия делится на два типа:
- цис-изомерия – радикалы располагаются по одну сторону от условной плоскости, разделяющей молекулу надвое;
- трансизомерия – радикалы лежат по разные стороны условной плоскости.
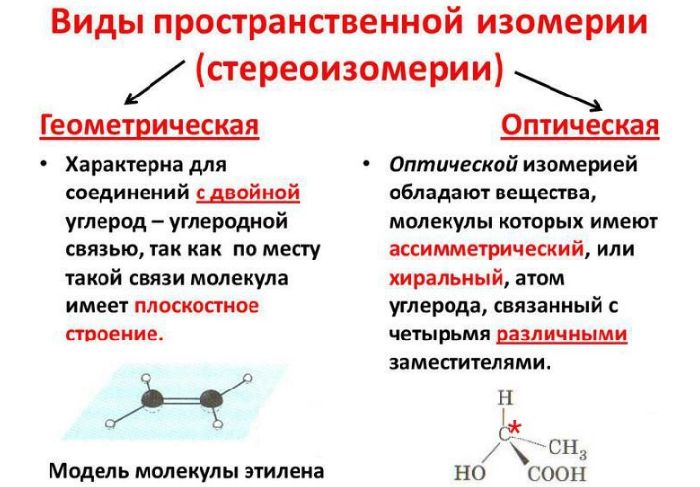
Изомеры пространственной изомерии называются стереоизомерами или пространственными изомерами. Зеркальные молекулы называются энантиомерами. Если молекулы не отражают друг друга, они называются диастереомерами или геометрическими изомерами.
Что мы узнали?
Изомерия – явление возникновения изомеров. Это вещества, одинаковые по составу, но разные по строению и расположению в пространстве. Различают два типа – структурную и пространственную изомерию. Структурная изомерия отражает строение молекул. Это может проявляться углеродным скелетом, положением функциональной группы, кратными связями и заместителем. Выделяется также межклассовая структурная изомерия. Пространственная изомерия может быть оптической или геометрической. Это связано с особенностями расположения молекулы в пространстве.








Комментирование закрыто