Количество ковалентных связей, которые может образовать атом, называется валентностью элемента. Валентность атомов определяется наличием валентных электронов на внешнем энергетическом уровне.
Строение атома
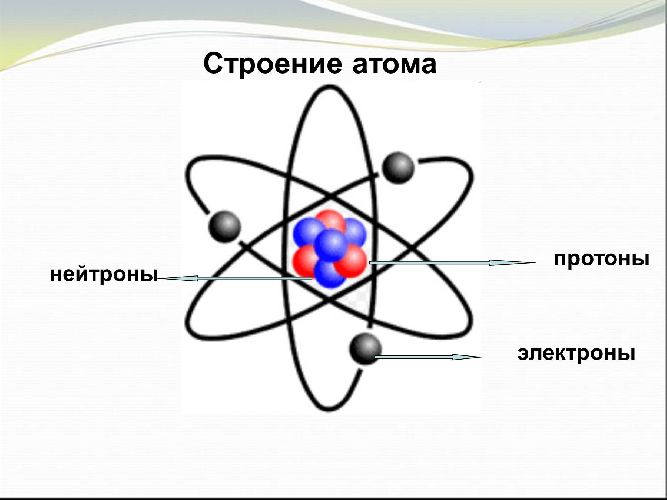
Все элементы на планете состоят из атомов. Это крошечные частицы, состоящие из положительно заряженного ядра и отрицательно заряженных электронов. Ядро содержит протоны и нейтроны. Электроны, притянутые к ядру, располагаются и движутся по орбиталям на разном расстоянии от центра. Неравномерное положение электронов по отношению к ядру называют энергетическими уровнями.
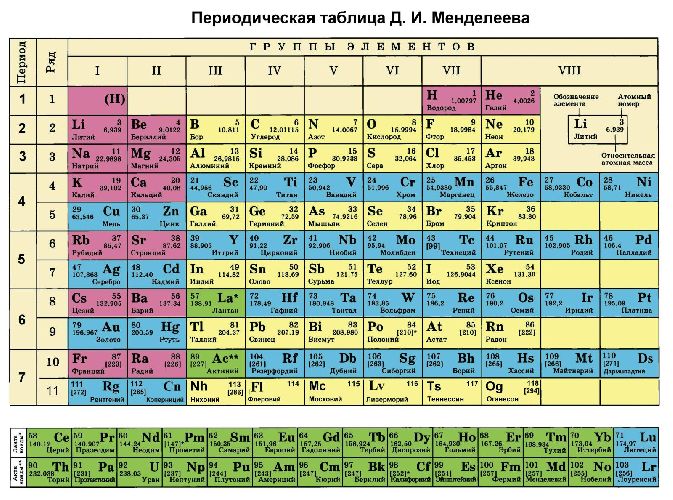
В таблице Менделеева высшая валентность соответствует номеру группы, в которой находится элемент. Количество энергетических уровней совпадает с номером периода, электронов – с порядковым номером.
Валентные возможности
Для оценки валентности атомов химических элементов необходимо подробно рассмотреть распределение электронов по энергетическим уровням.
Валентность соответствует числу неспаренных электронов, находящихся на s- и p-орбиталях внешнего энергетического уровня. Валентные электроны атомов элементов, входящих во вторичные группы таблицы Менделеева, расположены на s-орбитали внешнего уровня и d-орбиталях, образующих внешний подуровень.
В нормальном (стационарном) состоянии электроны занимают в атоме определенное положение. Стационарная электронная конфигурация зафиксирована в таблице Менделеева. В возбужденном состоянии (реакция с другими элементами) энергия атома перераспределяется и электроны меняют положение.
Давайте посмотрим на пример. Атом фосфора в стационарном положении имеет электронную конфигурацию 1s22s22p63s23p3. Это означает, что 15 электронов распределены по трем уровням. Внешний уровень, включающий s- и p-орбитали, содержит пять валентных электронов. В этом случае три электрона на р-орбитали являются неспаренными, а два электрона на s-орбитали образуют пару. Следовательно, три неспаренных электрона могут образовывать ковалентные связи, а валентность фосфора равна трем.
Фосфор находится в группе V, главной подгруппе. Это означает, что атом содержит пустой d-подуровень. В возбужденном состоянии спаренные электроны на s-уровне спариваются, и один электрон переходит на d-подуровень. Образуются пять свободных неспаренных электронов. Следовательно, атом фосфора приобретает пятую валентность.
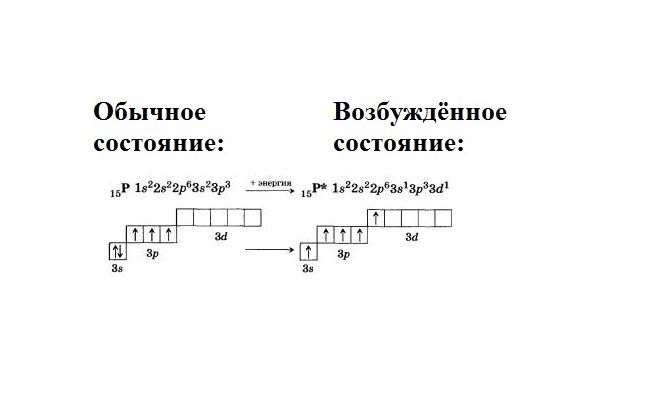
Пропаривание происходит с потреблением энергии. Затраты энергии компенсируются образованием ковалентных связей с выделением энергии.
В зависимости от возможности переходить в возбуждённое состояние элементы делятся на две группы: с переменной и постоянной валентностью. Постоянную валентность (соответствует номеру группы) имеют щелочные, щелочноземельные металлы, фтор и алюминий. Переменная валентность присуща всем остальным элементам. Инертные газы не вступают в реакции, поэтому считается, что валентность у них отсутствует.
Что мы узнали?
Валентность показывает, сколько атомов элемент может присоединить ковалентными связями. Значение валентности совпадает с числом электронов на внешнем энергетическом уровне и соответствует номеру группы периодической системы, в которой находится элемент. Благодаря способности переходить в возбужденное состояние большинство элементов имеют переменную валентность. Активные металлы и фтор сохраняют одинаковую валентность во всех состояниях.







Комментирование закрыто