
Способность элемента присоединять атомы называется валентностью химических элементов. Валентность помогает правильно разместить индексы элементов в формулах.
Что это?
Каждый элемент состоит из атомов. Атом – это мельчайшая частица, состоящая из положительно заряженного ядра и электронов, вращающихся вокруг ядра. Электроны движутся на разных уровнях. Количество уровней конкретного элемента соответствует периоду в таблице Менделеева.
Внешний энергетический уровень содержит определенное количество электронов. Именно эти электроны способны образовывать ковалентные химические связи и присоединять к себе равное количество электронов от другого элемента.
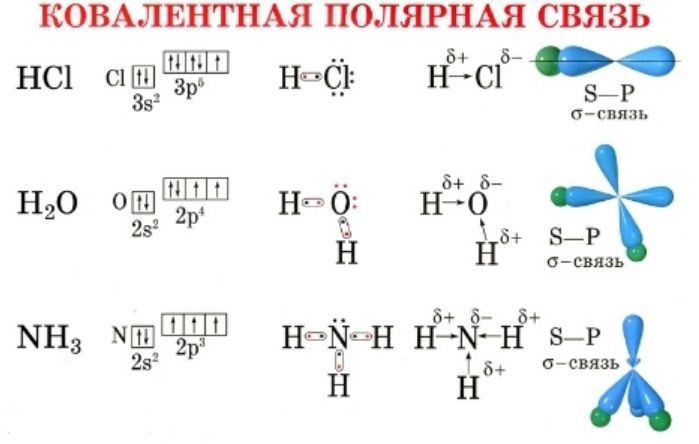
Число атомов равно числу химических связей. Внешний энергетический уровень не может содержать более восьми электронов, поэтому валентность колеблется от I до VIII.
Не следует путать валентность и степень окисления. Валентность указывает на количество присоединённых атомов, окисление – на условный заряд, который получает элемент при отдаче или принятии электронов. Степень окисления не зависит от вида ионной связи и может быть положительной, отрицательной или нулевой.
Как находится
Нет необходимости запоминать, сколько атомов находится на внешнем энергетическом уровне каждого элемента. Достаточно воспользоваться таблицей валентности химических элементов или ориентироваться на периодическую систему Менделеева. Номер группы, обозначаемый римской цифрой, указывает на высшую валентность элемента – максимальное количество химических связей.
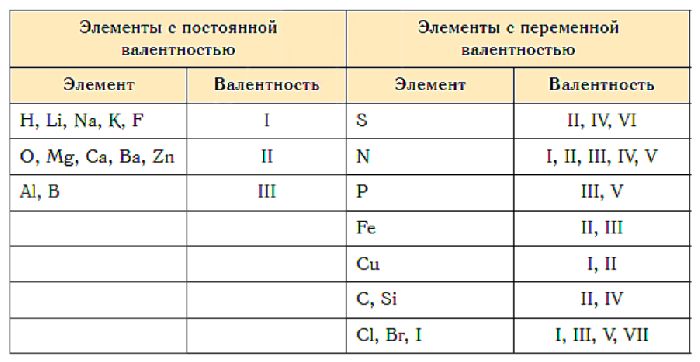
Некоторые элементы имеют две или три валентности. Это связано с тем, что атом может перейти в возбужденное состояние и образовать дополнительные связи. Сера может проявлять II, IV или VI валентность в зависимости от соединения:
- H 2 S(II);
- СО 2 (IV);
- SO3(VI).
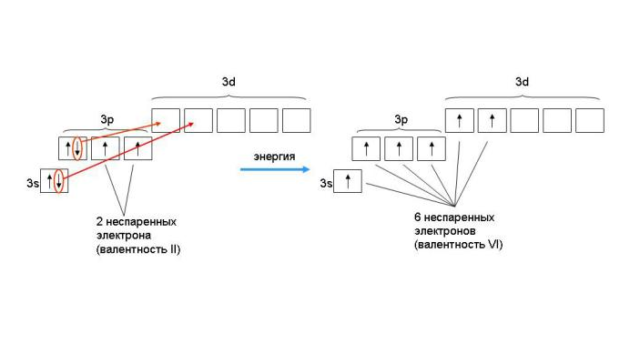
Электронная конфигурация серы — 1s22s22p63s23p4. Внешний p-уровень содержит четыре электрона, два из которых неспаренные, поэтому сера в нормальном состоянии двухвалентна. В возбужденном состоянии один из спаренных электронов переходит на пустой d-подуровень. Атом способен образовывать четыре связи, поэтому валентность серы становится IV. При дальнейшем возбуждении помимо электрона с p-уровня на d-подуровень переходит один из спаренных электронов на 3s-уровне. В результате шесть электронов становятся неспаренными, а сера проявляет высшую валентность – VI.
Постоянная валентность характерна для металлов основных подгрупп и некоторых неметаллов. К ним относятся:
- водород (I);
- кислород (II);
- литий(я);
- бериллий(II);
- бор (III);
- фтор(I);
- натрий (I);
- магний (II);
- алюминий(III);
- калий (I);
- цинк(II);
- кальций(II).
Инертные газы химически неактивны. Поэтому принято считать, что их валентность, вне зависимости от количества атомов на внешнем уровне, равна нулю.
Зачем используется
Валентность важна при создании формул. С помощью валентности задаются индексы элементов, и при наличии индексов легко определить валентность элементов.
Для определения индексов следуйте следующему алгоритму:
- определить валентность элементов в формуле (P – V, O – II);
- найти наименьшее кратное валентностей (5∙2=10);
- поочередно разделите кратное на валентность элементов (10/5=2, 10/2=5);
- запишите соответствующие символы (P2O5).
Зная формулу, можно определить переменную валентность элемента. В формуле Fe2O3 валентность кислорода равна 2. Необходимо значение валентности умножить на кислородный индекс и разделить на индекс железа: 2∙3/2=3. Валентность железа III.
Что мы узнали?
Из урока 8 класса мы узнали о понятии валентности. Валентность показывает количество возможных химических связей с другим элементом или количество атомов, к которым может присоединиться элемент. Высшую валентность легко определить по таблице Менделеева — значение соответствует группе элемента. Элементы могут иметь одну или несколько валентностей. Способность менять валентность связана с возбужденным состоянием элемента. С помощью валентности можно рассчитать индексы в химических формулах и определить переменную валентность элемента.








Комментирование закрыто