
В 1887 году шведский химик Аррениус сформулировал теорию электролитической диссоциации. Теория объясняет, почему водные растворы солей, кислот и щелочей проводят электричество.
Электролитическая диссоциация
Аррениус, изучая растворы, заметил, что некоторые из них проводят электрический ток. Чтобы понять, как именно это происходит, следует вспомнить определение электрического тока. Это упорядоченное движение заряженных частиц. Следовательно, эти частицы должны присутствовать в растворе.
Заряженные частицы, переносящие электрический ток, — это ионы. Их разделяют на положительно заряженные катионы и отрицательно заряженные анионы.
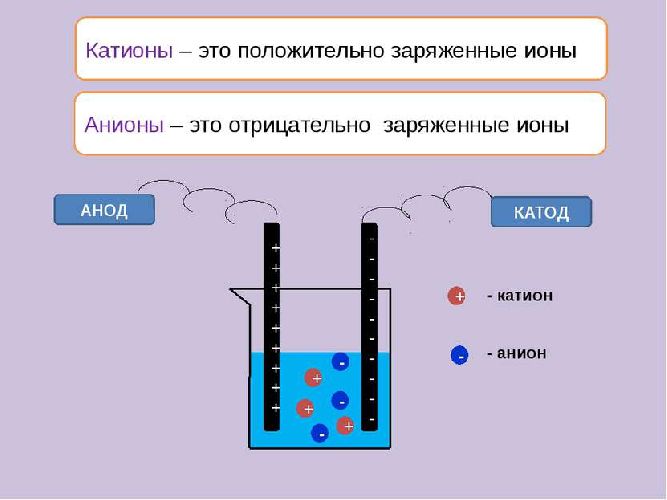
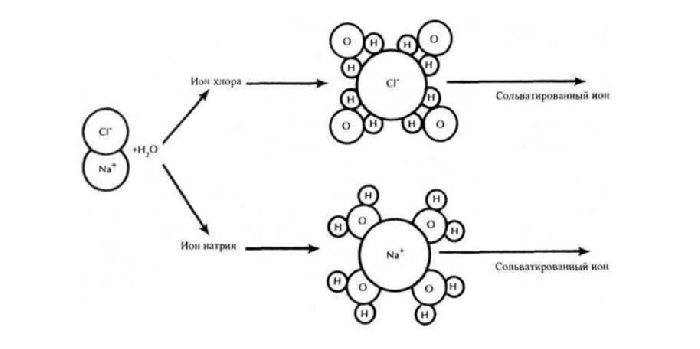
Ионы образуются в результате распада (расщепления) молекул веществ. Это может произойти в растворе под воздействием молекул воды или при высоких температурах в расплаве. Распад молекул на ионы называется электролитической диссоциацией.
Электролиты и неэлектролиты
Не все вещества распадаются на ионы под воздействием воды. Поэтому выделяют две группы веществ:
- электролиты – молекулы распадаются на ионы;
- неэлектролиты – молекулы не распадаются на ионы.
К электролитам относятся сложные неорганические вещества:
- кислоты;
- обоснование;
- расплавы и растворы солей;
- твердые соли;
- некоторые твердые оксиды;
- гидроксиды.
Неэлектролитами являются большинство органических веществ. К ним относятся:
- альдегиды;
- кетоны;
- углеводороды;
- углеводы.
Сущностью электролитической диссоциации является распад ковалентных полярных или ионных связей. Молекулы воды оттягивают полярные молекулы, увеличивая полярность, и разрывают их на ионы. В расплавах при высокой температуре ионы в кристаллической решётке начинают совершать колебания, которые приводят к разрушению кристалла. Ковалентные неполярные связи, присутствующие в простых веществах, достаточно прочны и не разрываются молекулами воды или при нагревании.
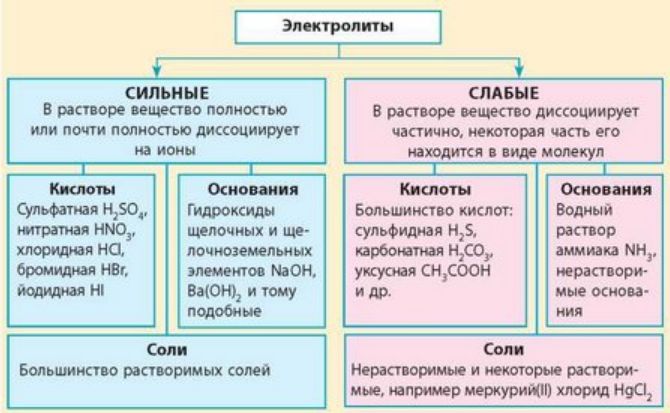
Виды электролитов
Электролитическая диссоциация характеризуется степенью диссоциации. Это величина, которая отражает соотношение между количеством распавшихся молекул и общим числом молекул в веществе. Степень диссоциации показывает долю молекул вещества, распавшихся на ионы. Выражается формулой
где n — количество изношенных молекул, N — общее количество молекул.
По степени диссоциации различают две группы электролитов:
- сильный – практически полностью распадается в ненасыщенных растворах (сильных кислотах, солях, щелочах);
- слабые – частично распадаются или не разлагаются (слабые кислоты, легкорастворимые соли, нерастворимые основания, гидроксид аммония).
Ненасыщенный раствор содержит небольшую концентрацию растворённого вещества. Это значит, в раствор можно добавить ещё некоторое количество вещества.
Положения теории
Изучив электролиты, Аррениус сформулировал основные положения теории электролитической диссоциации:
- вещества при взаимодействии с водой распадаются на ионы – катионы и анионы;
- электрический ток заставляет катионы двигаться к катоду, а анионы — к аноду;
- диссоциация — обратимый процесс для слабых электролитов.
Что мы узнали?
На уроке химии в 9-м классе мы узнали об электролитической диссоциации. В растворах под действием молекул воды или в расплавах под действием температуры молекулы веществ распадаются на ионы. Образующиеся заряженные частицы — анионы и катионы — способны проводить электрический ток. Таким образом, растворенное вещество проводит электричество и является электролитом. Теорию электролитической диссоциации сформулировал химик Аррениус.








Комментирование закрыто