
Степень окисления – это общепринятая величина, используемая для регистрации окислительно-восстановительных реакций. Для определения степени окисления используют таблицу окисления химических элементов.
Значение
Степень окисления основных химических элементов основана на их электроотрицательности. Величина равна числу смещенных электронов в соединениях.
Степень окисления считается положительной, если электроны вытеснены из атома, т.е элемент отдает электроны в соединении и является восстановителем. Эти элементы включают металлы; степень их окисления всегда положительна.
Когда электрон движется к атому, значение считается отрицательным, а элемент считается окислителем. Атом принимает электроны до тех пор, пока не завершится его внешний энергетический уровень. Большинство неметаллов являются окислителями.
Простые вещества, не вступающие в реакцию, всегда имеют нулевую степень окисления.
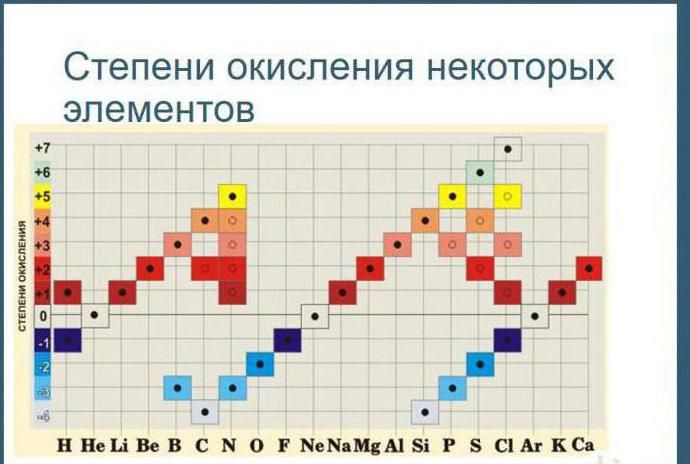
В соединении положительную степень окисления имеет атом неметалла с меньшей электроотрицательностью.
Определение
Определить максимальную и низшую степени окисления (сколько электронов может отдать и принять атом) можно с помощью таблицы Менделеева.
Максимальная степень равна номеру группы, в которой находится элемент, или количеству валентных электронов. Минимальное значение определяется по формуле:
Углерод находится в четвертой группе, поэтому его высшая степень окисления +4, а низшая – -4. Максимальная степень окисления серы +6, минимальная -2. Большинство неметаллов всегда имеют переменную – положительную и отрицательную – степень окисления. Исключение составляет фтор. Его степень окисления всегда равна -1.
Следует помнить, что это правило не распространяется на щелочные и щелочноземельные металлы I и II групп соответственно. Эти металлы имеют постоянную положительную степень окисления — литий Li+1, натрий Na+1, калий K+1, бериллий Be+2, магний Mg+2, кальций Ca+2, стронций Sr+2, барий Ba+2. Другие металлы могут иметь разную степень окисления. Исключение составляет алюминий. Несмотря на то, что он находится в группе III, его степень окисления всегда +3.
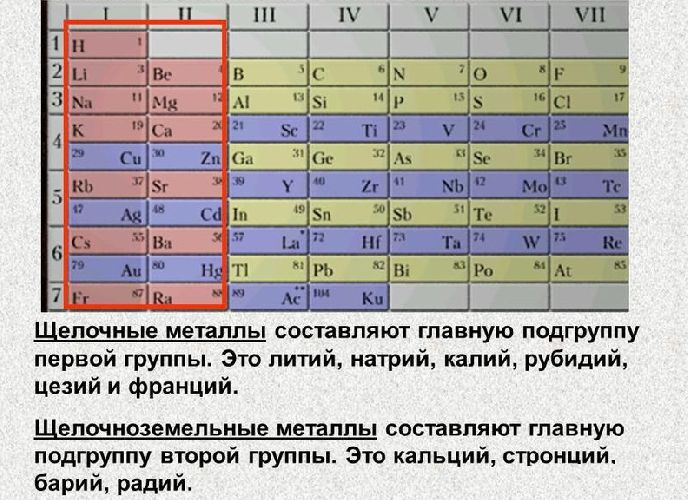
Из VIII группы высшую степень окисления +8 могут проявлять только рутений и осмий. Находящиеся в I группе золото и медь проявляют степень окисления +3 и +2 соответственно.
Запись
Чтобы правильно записать степень окисления, следует запомнить несколько правил:
- инертные газы не вступают в реакцию, поэтому степень их окисления всегда равна нулю;
- в соединениях переменная степень окисления зависит от переменной валентности и взаимодействия с другими элементами;
- водород в соединениях с металлами имеет отрицательную степень окисления — Ca+2H2-1, Na+1H-1;
- кислород всегда имеет степень окисления -2, за исключением фторида и перекиси кислорода — O+2F2−1, H2+1O2−1.
Что мы узнали?
Степень окисления — это условная величина, показывающая, сколько электронов принял или отдал атом элемента в соединении. Величина зависит от количества валентных электронов. Металлы в соединениях всегда имеют положительную степень окисления, т е являются восстановителями. Для щелочных и щелочноземельных металлов степень окисления всегда одинакова. Неметаллы, за исключением фтора, могут иметь положительные и отрицательные степени окисления.








Комментирование закрыто