
Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород. В названиях оксидов сначала указывается слово оксид, затем название другого элемента, из которого он образован. Какими свойствами обладают кислотные оксиды и чем они отличаются от других типов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже из названия понятно, что несолеобразующий солей не образует. Таких оксидов немного: вода H2 O, фторид кислорода OF2 (если условно считать оксидом), окись углерода или окись углерода (II), окись углерода CO; оксиды азота (I) и (II): N2 O (оксид азота, закись азота) и NO (оксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородсодержащие кислоты. Соответственно их называют основными оксидами (например, CaO), амфотерными оксидами (Al2O3) и кислотными оксидами или ангидридами кислот (CO2).
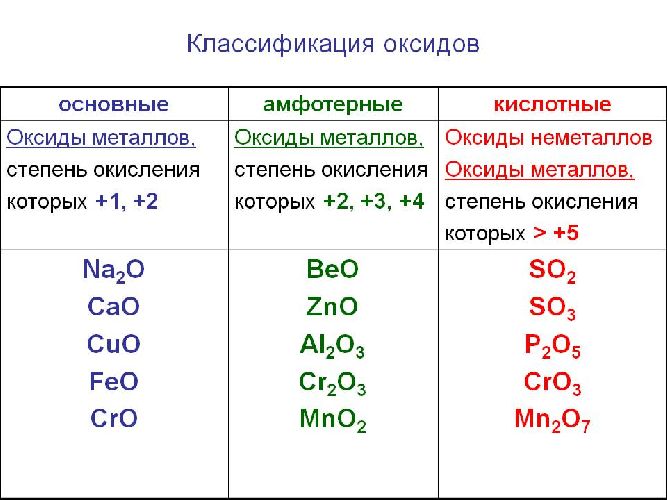
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
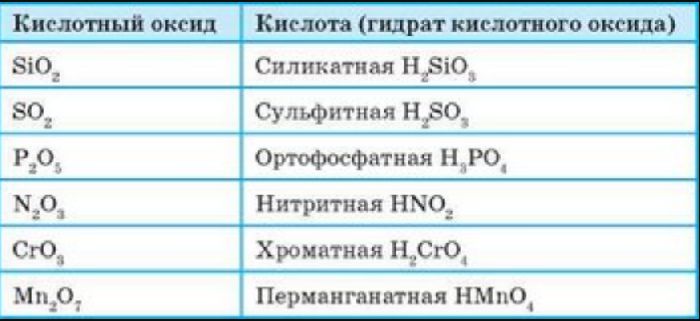
Кислотные оксиды (ангидриды) — вещества, проявляющие кислотные свойства и образующие кислородсодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2, SO3 соответствуют кислоты H2SO3 и H2SO4 .
Кислотные оксиды, образующиеся из неметаллов и металлов переменной валентности в высшей степени окисления (например SO3, Mn2 O7), реагируют с основными оксидами и щелочами, образуя соли:
Типичными реакциями являются взаимодействие кислых оксидов с основаниями, приводящее к образованию соли и воды:
Все кислые оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой с образованием кислот:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI | SO3 | легколетучая, бесцветная, токсичная жидкость |
| Окись углерода (IV) | СО2 | бесцветный газ без запаха |
| Оксид кремния (IV | SiO2 | бесцветные кристаллы с прочностью |
| Оксид фосфора(V | П2 О5 | белый легковоспламеняющийся порошок с неприятным запахом |
| Оксид азота (V) | N205 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII | Кл207 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца(VII | Мн207 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Что мы узнали?
Кислотные оксиды являются солеобразующими оксидами и образуются с помощью кислот. Кислотные оксиды реагируют с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.








Комментирование закрыто