
Метан – первый представитель ряда алканов с формулой CH4. Это бесцветный природный газ без запаха. Благодаря своим физическим и химическим свойствам метан используется в качестве топлива.
Строение
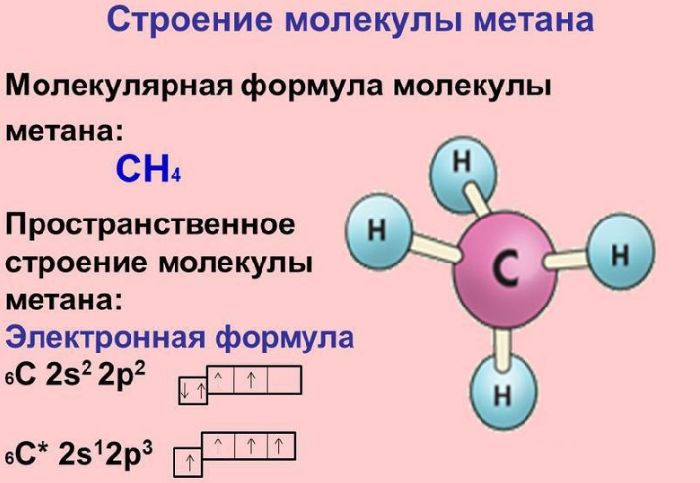
Молекула метана представляет собой тетраэдр, в центре находится углерод, связанный простыми (одинарными) σ-связями с атомами водорода. Строение и свойства молекулы метана важны для понимания всей органической химии, поскольку большинство органических соединений содержат метильные группы -СН2.
Метан образует гомологический ряд алканов. Каждый последующий гомолог отличается от предыдущего группой -CH2. Из-за своей тетраэдрической конфигурации длинные молекулы алканов выглядят как изогнутые цепи.
Получение
Метан — распространенный газ во Вселенной. Он содержится в природном и попутном газе, образуется на дне моря и выделяется как конечный продукт жизнедеятельности кишечных бактерий. Метан входит в состав атмосферы планет-гигантов. На поверхности Титана, спутника Сатурна, расположены этано-метановые озера и реки.

В промышленности метан отделяют от природного газа и получают путем коксования (прокаливания) угля.
В лаборатории метан образуется при нагревании сухого гидроксида натрия с уксусной кислотой, а также при плавлении ацетата с гидроксидом натрия:
- 2NaOH + CH3COOH → Na2CO3 + H2O + CH4;
- CH3COONa + NaOH → CH4 + Na2CO3.
Впервые метан обнаружил на болотах физик Алессандро Вольта в 1776 году. Два года спустя он выделил из болотного газа чистый метан.
Свойства
Основные физические характеристики:
- легче воздуха;
- без запаха и вкуса;
- плохо растворяется в воде;
- молекулярная масса — 16;
- температура плавления – -182,49°С;
- температура кипения — -161,56°С;
- температура вспышки – -188°С;
- температура самовоспламенения – 537,8°С.
Метан определяет физико-химические свойства гомологического ряда алканов. В обычных условиях метан и его гомологи неактивны и реагируют под действием высокой температуры и катализатора. Для разрыва связи CH необходимы дополнительные условия.
Основные реакции метана:
- нитрование:
СН4 + HONO2 → CH3-NO2 + H2O;
- галогенирование:
СН4 + Cl2 → CH3Cl + HCl;
- сульфохлорирование:
CH4 + SO2 + Cl2 → CH3-SO2Cl + HCl↑;
- каталитическое окисление под действием солей меди и марганца:
2СН4 + О2 -> 2СН3ОН;
- полное окисление (сгорание):
СН4 + 2О2 → СО2 + 2Н2О + Q;
- паровое окисление:
СН4 + Н2О → СО + 3Н2;
- крекинг (способ переработки нефти):
2CH4 -> HC=CH + 3H2.

Концентрация метана в воздухе более 4 % взрывоопасна. Поэтому метану специально придают запах, смешивая газ с тиолами, содержащими серу. Это помогает контролировать утечку бытового газа.
Что мы узнали?
Метан — простейший представитель класса алканов, образующий гомологический ряд. Это бесцветный горючий газ, выделяющийся из природного газа и образующийся при коксовании угля. В качестве топлива используется метан. Самовоспламеняется при высоких температурах. Газ подвергается нитрованию, галогенированию, сульфохлорированию, окислению под воздействием катализатора, водяного пара, горению, а также крекингу, применяемому при нефтепереработке.








Комментирование закрыто