
Азот – химический элемент V группы периодической системы Менделеева, имеющий атомный номер 7 и атомную массу 14,00674. Какими свойствами обладает этот элемент?
Физические свойства азота
Азот – двухатомный газ без запаха, цвета и вкуса. Температура кипения азота при атмосферном давлении -195,8 градусов, температура плавления -209,9 градусов. Растворимость в воде при 20 градусах очень низкая – 15,4 мл/л.
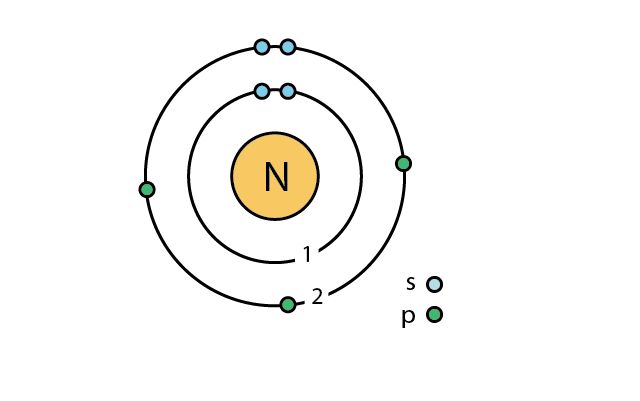
Атмосферный азот состоит из двух изотопов: 14N (99,64%) и 15N (0,36%). Известны также радиоактивные изотопы азота 13N и 16N.
Перевод названия элемента «азот» – безжизненный. Это название справедливо для азота, как для простого вещества, но в связанном состоянии он является одним из главных элементов жизни, а также входит в состав белков, нуклеиновых кислот, витаминов и т д.
Химические свойства азота
В молекуле азота химическая связь осуществляется за счет трех общих пар p-электронов, орбитали которых направлены по осям x,y,z.
Ковалентная связь, образующаяся при перекрытии орбиталей вдоль линии, соединяющей центры соединяющихся атомов, называется q-связью.
Ковалентная связь, возникающая при перекрытии орбиталей по обе стороны от линии, соединяющей центры соединяющихся атомов, называется π-связью. В молекуле азота имеется одна q-связь и две p-связи.
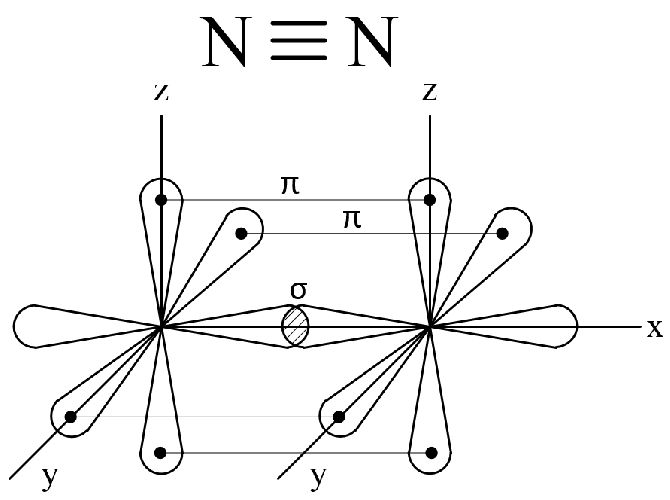
Молекулярный азот – химически малоактивное вещество, это объясняется тройной связью между атомами азота и ее малой длиной
В обычных условиях азот реагирует только с литием:
При высоких температурах связи между атомами ослабляются и азот становится более реакционноспособным. При нагревании он может взаимодействовать с другими металлами, например с магнием, кальцием, алюминием с образованием нитридов:
Пропуская азот через раскаленный кокс, продайте сообщение азота с коробором — дициан.
С оксидом алюминия и углекислым газом при высокой температуре также образуется нитрид алюминия:
а с содой и углем – цианид натрия:
При контакте с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксидов металлов:
При температуре электрической дуги (3000-4000 градусов) азот вступает в реакцию с кислородом:
Карбид кальция CaC2 при высокой температуре поглощает азот с образованием цианамида кальция:
Эта реакция была использована в одном из первых методов промышленного связывания азота.
В присутствии катализатора при высокой температуре и давлении азот способен вступать в реакцию с водородом:
Что мы узнали?
Азот – химический элемент, способный проверить валентность III и IV. Также в статье рассмотрены физико-химические свойства азота, дана характеристика этого элемента и реакции, в которые этот элемент способен вступать в обычных условиях и под действием катализаторов.








Комментирование закрыто