
Нитрид водорода с формулой NH3 называется аммиаком. Это легкий (легче входка) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.
Строение
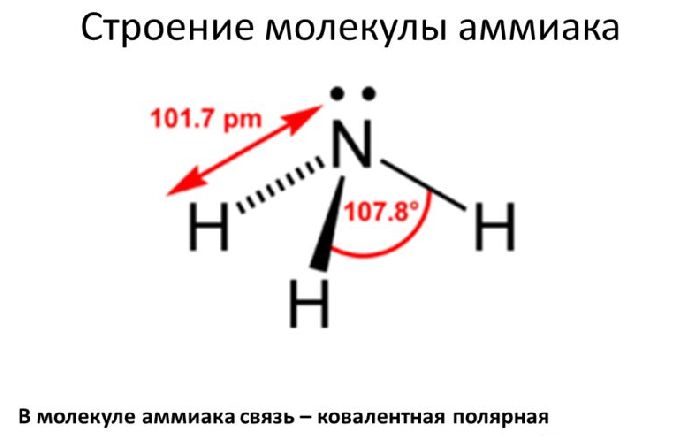
Молекула аммиака состоит из одного атома азота и трех атомов водорода. Ковалентные связи между атомами водорода и азота. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота имеется три свободных электрона. С ними в гибридизацию вступают три атома водорода, образуя sp3-гибридизацию.
Если один атом водорода заменить углеводородным радикалом (CnHm), то получится новое органическое вещество – амин. Заменить можно не только один атом водорода, но и все три. В зависимости от числа замещенных атомов различают три типа аминов:
- первичный (метиламин – CH3NH2);
- вторичный (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединяться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растровость в воде (на один обём воды 700 объёмов амнойка при 20°С, при 0°С – 1200);
- более легкий воздух.
Аммиак кипит при температуре -33°С и затвердевает при -78°С. Концентрированный раствор содержит 25% аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не растворяет электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отбирая у него три электрона. Благодаря оставшейся паре электронов азота и легкому разделению атомов водорода аммиак является активным соединением, реагирующим с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
|
Взаимодействие |
Реакция продукта |
Уравнение |
|
С кислородом |
Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота |
– 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
|
С галогенами |
Азот, кислота |
2NH3 + 3Br2 → N2 + 6HBr |
|
С водой |
Гидроксид аммиака или гидроксид натрия |
NH3 + H2O → NH4OH |
|
С эксирами |
Соли аммиака |
– NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
|
С солями |
Заменяет металл, образуя новую соль |
2NH3 + CuSO4 → (NH4)2SO4 + Cu |
|
С оксидами металлов |
Металл регенерируется, образуется азот |
2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Что мы узнали?
Мы выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный легкий газ с резким запахом. Он кипит при низкой температуре. Раствор амнойка – хороший развотчик. Он способен отдавать атомы водорода, присоединять углеводородные радикалы и образовывать амины. Аммиак реагирует за счет оставшейся электронной пары азота с простыми и сложными веществами — галогенами, кислородом, водой, кислотами, солями, оксидами.








Комментирование закрыто