
Металлы – это твердые элементы, сплавы которых широко используются в промышленности, строительстве и быту. Пластичность, твердость, тепло- и электропроводность, а также способность плавиться и ковать определяются строением металлов.
Строение
Электронная структура атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Число протонов, заряд ядра и количество электронов соответствуют атомному номеру металла в периодической таблице.
Электроны в атомах металлов расположены значительно дальше от ядра, чем электроны в неметаллах. Этим объясняется легкое разделение валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
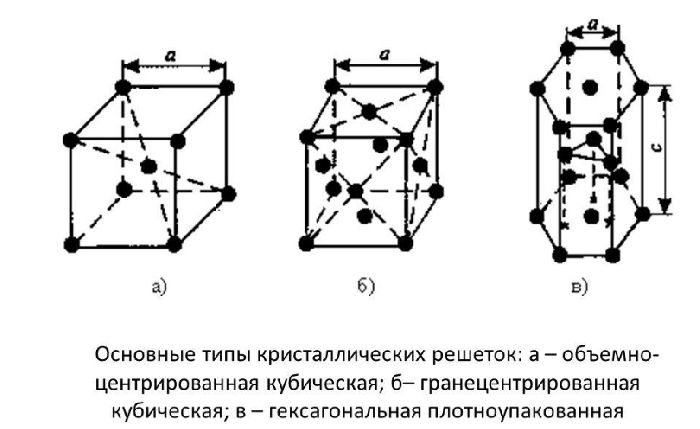
Атомы всех металлов, за исключением ртути, образуют кристаллические решетки. Кристаллическая решетка состоит из повторяющихся комплексов атомов — элементарных кристаллических ячеек, которые бывают трех типов. Их отличия описаны в таблице металлоконструкций.
|
Тип гриля |
Характеристика |
Примеры |
|
Телоцентрированная кубическая (BCC) |
восемь ионов размещены по углам обычного куба, один — в центре |
Fe, Cr, Mo, W, V |
|
Кубическая грань по центру |
Ионы размещаются в углах куба и в центре каждой стороны. Центр куба свободен |
Cu, Ag, Ni, Pb, Al |
|
Шестиугольные плотно упакованные |
Шестиугольная призма. В углах и посередине между ними находятся ионы. В центре призмы находятся ионы, образующие треугольник |
Zn, Ti, Mg, Co, Zr |
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- иметь металлический блеск;
- проводят электрический ток и тепло;
- не имеет запаха;
- имеет серебристо-серый цвет (исключение составляют медь и золото).
Благодаря пластичности и плавлению металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальную часть составляют случайные примеси и специально вводимые вещества. Сплавы характеризуются высокой прочностью, эластичностью и хрупкостью. Широкое распространение получили сплавы на основе железа (черные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Виды
Классификация металлов приведена в таблице.
|
В разводе |
Вид |
Пример |
|
Температура кипения |
Легкоплавкие (Т<1000°С) |
К, Ал, Цинк |
|
Огнеупорный (Т>1000°С) |
Au, Cu, Ni |
|
|
Плотность |
Легкие (ρ<5 г/см3) |
Ли |
|
Тяжелый (ρ>5 г/см3) |
Нас |
|
|
Твердость |
Мягкая — режут ножом |
Na, Rb, Cs |
|
Твердый – используется для резки |
Кр |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Химические свойства
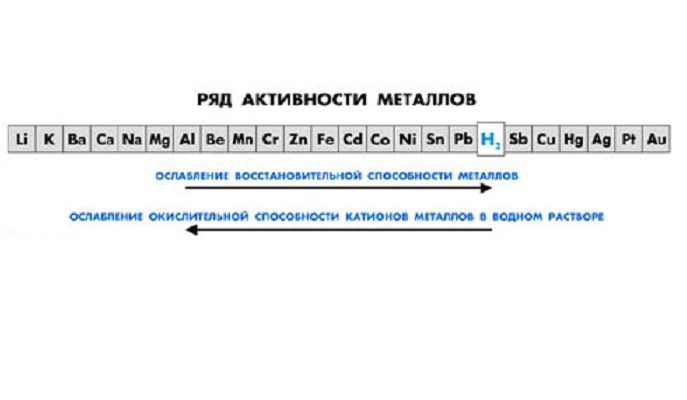
Металлы являются восстановителями и реагируют с неметаллами с образованием оксидов, гидроксидов и солей. Наиболее активны щелочные и щелочноземельные металлы, помещенные в I и II группы таблицы Менделеева. Драгоценные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
|
Взаимодействие |
Продукты |
Уравнение |
|
С кислородом |
Оксиды |
2Mg + O2 → 2MgO |
|
С серой |
Сульфиды |
Zn + S → ZnS |
|
С азотом |
Нитриды |
6Li + N2 → 2Li3N |
|
С фосфором |
Фосфиды |
3Ca + 2P → Ca3P2 |
|
С галогенами |
Галогениды |
2Na + Cl2 → 2NaCl |
|
С водой |
Гидроксиды |
2Na + 2H2O → 2NaOH + H2 |
|
С кислотами |
Соли |
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
|
С солями (заменить менее активные металлы) |
Соль |
2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.

Что мы узнали?
Мы исследовали структурные свойства атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, различающихся по конфигурации. Элементы обладают металлическим блеском, электропроводностью, пластичностью и твердостью. Металлы являются восстановителями. Наиболее активны в I и II группах таблицы Менделеева. Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.








Комментирование закрыто