
Атом – мельчайшая частица вещества, состоящая из ядра и электронов. Строение электронных оболочек атомов определяется положением элемента в периодической таблице химических элементов Д. И. Менделеева.
Электрон и электронная оболочка атома
Атом, который обычно является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронного облака), причем суммарные положительные и отрицательные заряды равны по абсолютной величине. При расчете относительной атомной массы масса электронов не учитывается, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Электрон — совершенно уникальная частица, имеющая двойственную природу: он обладает свойствами и волны, и частицы. Они непрерывно перемещаются вокруг ядра.
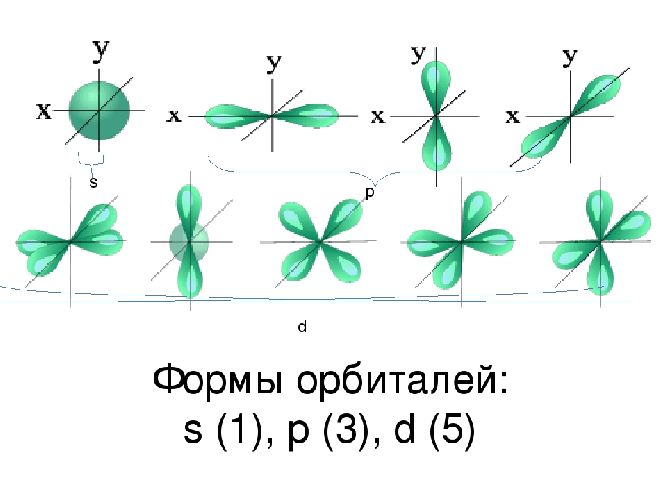
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
Вокруг ядра электроны располагаются электронными слоями. Каждый слой характеризуется своим расстоянием от ядра и своей энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в атомном ядре и, следовательно, числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, находящихся в ядре этого атома. Каждый последующий элемент имеет на один протон больше в ядре и на один электрон в электронной оболочке.
Вновь входящий электрон занимает орбиталь с самой низкой энергией. Однако максимальное количество электронов на уровне определяется по формуле:
где N — максимальное количество электронов, а n — число на энергетическом уровне.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Строение электронных оболочек атомов
Каждый элемент соответствует определенному периоду. Период — это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, начиная со щелочного металла и заканчивая инертным газом. Первые три периода в таблице маленькие, а следующие, начиная с четвертого периода, большие и состоят из двух строк. Номер периода, в котором находится элемент, имеет физический смысл. Это означает, сколько электронных энергетических уровней имеется в атоме элемента в данный период. Таким образом, элемент хлор Cl находится в периоде 3, то есть электронная оболочка имеет три электронных слоя. Хлор находится в VII группе таблицы, и в основной подгруппе. Основная подгруппа — это столбец в каждой группе, который начинается с периода 1 или 2.
Таким образом, состояние электронных оболочек атома хлора следующее: атомный номер элемента хлора равен 17, что означает, что атом имеет 17 протонов в ядре и 17 электронов в электронной оболочке. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в основной подгруппе VII группы. Итак, на уровне 2 это: 17-2-7 = 8 электронов.
Что мы узнали?
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Это также дает представление о распределении электронов между уровнями в таблице Менделеева.








Комментирование закрыто