
Углерод (C) — шестой элемент в таблице Менделеева с атомным весом 12. Этот элемент является неметаллом и имеет изотоп 14C. Строение атома углерода лежит в основе всей органической химии, поскольку все органические вещества содержат молекулы углерода.
Атом углерода
Положение углерода в таблице Менделеева:
- шестой серийный номер;
- четвертая группа;
- второй период.
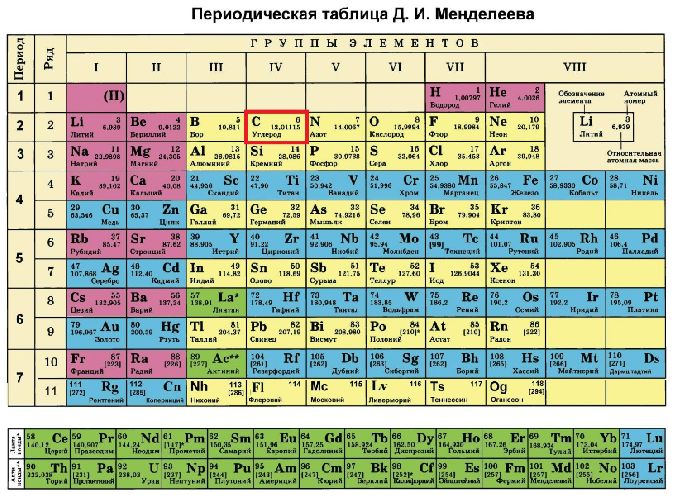
На основании данных таблицы можно сделать вывод, что в структуру атома элемента углерода входят две оболочки, на которых расположены шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это означает, что на внешнем электронном уровне четыре электрона, а на внутреннем — два.
Из четырех электронов два занимают сферическую 2s-орбиталь, а остальные два — 2p-орбиталь в форме гантели. В возбужденном состоянии один электрон переходит с 2s-орбитали на одну из 2p-орбиталей. Когда электрон перемещается с одной орбитали на другую, расходуется энергия.
Таким образом, возбужденный атом углерода имеет четыре неспаренных электрона. Конфигурацию можно выразить формулой 2s12p3. Это позволяет образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода — одну связь между s-орбиталями водорода и углерода и три связи между р-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
Физические свойства
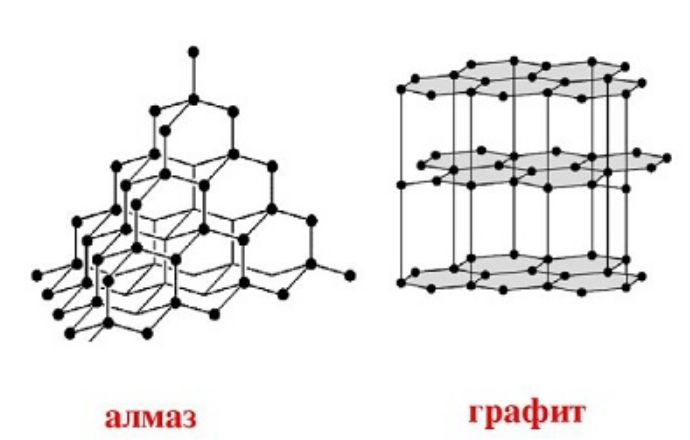
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карабин;
- уголь;
- сладкий.
Все эти вещества различаются строением кристаллической решетки. Самое твердое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Химические свойства
Атомная структура углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами с образованием карбидов:
- Са + 2С → СаС2;
- Кр + С → КрС;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, особенно с водородом, с образованием углеводородов:
С кислородом углерод образует углекислый газ и окись углерода:
- С + О2 -> СО2;
- 2С + О2 → 2СО.
Угарный газ образуется также при взаимодействии с водой:
Концентрированные кислоты окисляют углерод и образуют углекислый газ:
- 2H2SO4 + C → CO2 + 2S02 + 2H2O;
- 4HNO3 + C → CO2 + 4N02 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод — типичный неметалл с шестью электронами на s- и p-орбиталях. В активном состоянии он приобретает IV валентность и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.








Комментирование закрыто