
Сера (S) – неметалл, принадлежащий к группе халькогенов. Строение атома серы легко определить, обратившись к таблице Менделеева.
Строение
Сера в таблице Менделеева занимает 16-е место в третьем периоде, VI группе. Относительная атомная масса элемента равна 32.
Природная сера имеет несколько изотопов:
- 32С;
- 33С;
- 34С;
- 36С.
Кроме того, искусственно было получено 20 радиоактивных изотопов.
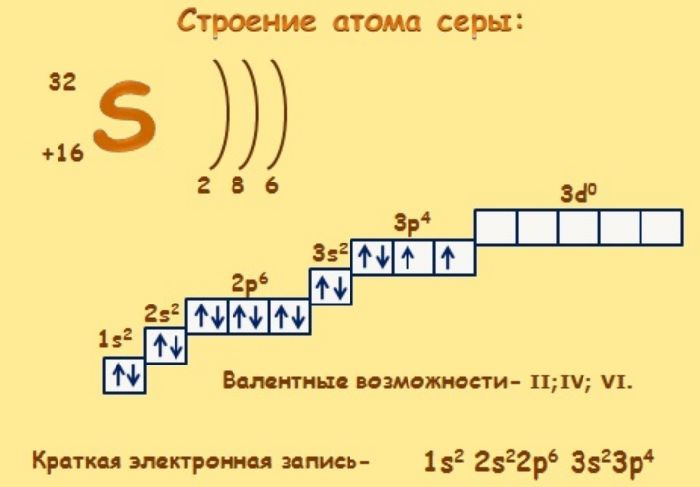
Сера — элемент p-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных в трёх электронных оболочках. Внешний энергетический уровень содержит 6 электронов, определяющих валентность элемента. Два электрона отсутствуют до завершения внешнего p-уровня, что определяет степень окисления серы как -2. Атом серы может перейти в возбужденное состояние за счет вакантных 3d-орбиталей (всего пять d-орбиталей). Следовательно, атом может иметь степени окисления +4 и +6.
Сера проявляет отрицательную степень окисления в составе солей – Al2S3, SiS2, Na2S. Четвертая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Высшая степень окисления (+6) имеет наиболее электроотрицательные элементы – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, принимающее при нагревании пластичную форму. Цвет неметалла варьируется от светло-желтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.

Сера — плохой проводник тепла и электричества. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не реагирует с соляной кислотой. Наиболее важные реакции серы с элементами описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Пример |
|
С металлами |
Сульфиды |
Cu + S → CuS |
|
С кислородом при 280°C |
Оксид серы |
– S + O2 → SO2; – 2S + 3O2 → 2SO3 |
|
С водородом при нагревании |
Сероводород |
H2 + S → H2S |
|
С фосфором при нагревании в отсутствие воздуха |
Сульфид фосфора |
2П + 3С → П2С3 |
|
С фторидом |
Фторид серы |
S + 3F2 → SF6 |
|
С углеродом |
Сероуглерод |
2S + С → CS2 |
|
С кислотами |
Кислота |
S + 2HNO3 → 2NO + H2SO4 |
|
Со щелочью |
Сульфиды и сульфиты |
3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – желтый кристаллический неметалл. Схема атомного строения – +16 С)2)8)6. Показывает три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, который реагирует с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Часть живых организмов. В природе встречается в свободной и связанной форме.








Комментирование закрыто