
Кремний (Si) – второй по распространенности неметалл в земной коре после кислорода. В природе он существует в соединениях и редко встречается в чистом виде. Строение атома кремния определяет свойства элемента.
Строение
Кремний — 14-й элемент таблицы Менделеева, расположенный в третьем периоде, в IV группе. Относительная атомная масса – 28.
Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра расположены три электронные оболочки, содержащие 14 электронов. Внешний энергетический уровень занят четырьмя электронами, определяющими валентность элемента. Кремний имеет степень окисления +2, поскольку на уровне 3p имеется два неспаренных электрона. Элемент может перейти в возбужденное состояние из-за свободной 3d-орбитали, которая показывает степень окисления +4.
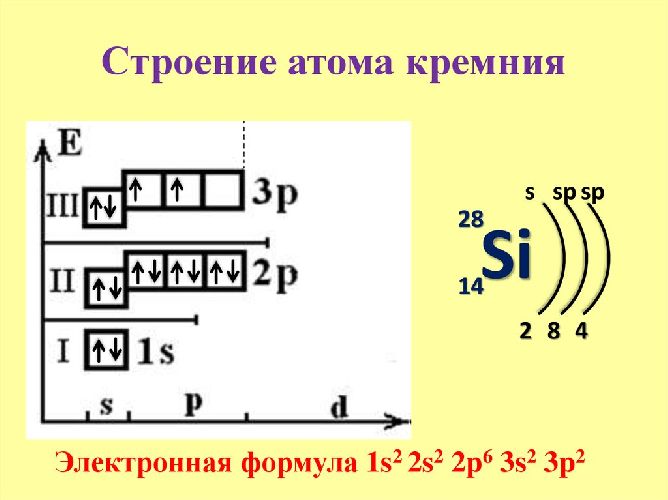
Схема строения атома кремния – 1s22s22p63s23p2 или +14 Si)2)8)4.
Физические свойства
Кремний — твердый элемент темно-серого цвета с металлическим блеском. Является полупроводником. Имеет модификацию, близкую по строению к аллотропной модификации углерода – алмазу. Однако связи между атомами кремния не такие прочные, как между атомами углерода.

Кремний в природе встречается в песке, глине, кварце и силикатах. Диоксид кремния (SiO2) – песок. Кремний получают прокаливанием песка с углеродом (углем) или металлами:
- 2C + SiO2 t˚→ Si + 2CO;
- 3Si02 + 4Al → 3Si + 2Al2O3;
- 2Mg + SiO2 t˚→ Si + 2MgO.
Кремний используется для производства радиоэлементов, фотоэлементов и для производства термостойких материалов.
Химические свойства
Благодаря своей электронной структуре кремний способен вступать в реакцию с другими элементами, принимая или отдавая электроны. В реакциях с металлами он действует как восстановитель, а в реакциях с неметаллами — как окислитель. В оптимальных условиях кремний реагирует только с фтором:
При нагревании реагирует:
- с кислородом (600°С) – Si + O2 → SiO2;
- с хлором (400°С) – Si + 2Cl2 → SiCl4;
- с углеродом (2000°С) – Si + C → SiC;
- с азотом (1000°С) – 3Si + 2N2 → Si3N4.
Является окислителем в реакциях с металлами:
Может реагировать с концентрированными щелочами с выделением водорода:
Кремний не реагирует непосредственно с водородом и кислотами, кроме плавиковой кислоты HF: Si + 6HF → H2[SiF6] + 2H2 или Si + 4HF → SiF4 + 2H2. Соединение с водородом – силан (SiH4) – получают разложением соли кислотой – Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Что мы узнали?
Кремний – неметалл четвертой группы таблицы Менделеева. Внешний энергетический уровень атома содержит четыре электрона. Имеет степень окисления +2. В природе он встречается в соединениях в виде глины, песка, кварца и других веществ. Существует только одна модификация кремния, похожая на алмаз. Кремний получают путем нагревания песка с углем или металлами. Элемент реагирует с неметаллами, металлами и щелочами. Не реагирует с водородом и кислотами (кроме HF.








Комментирование закрыто