
Атом – мельчайшая частица материи. Исследование началось еще в Древней Греции, когда строение атома привлекло внимание не только ученых, но и философов. Какова электронная структура атома и какая основная информация известна об этой частице?
Строение атома
Уже древнегреческие учёные догадались о существовании мельчайших химических частиц, входящих в состав каждого предмета и организма. И если в XVII-XVIII веках химики были уверены, что атом является неделимой элементарной частицей, то на рубеже XIX и XX веков удалось экспериментально доказать, что атом не является неделимым.
Атом, представляющий собой микроскопическую частицу вещества, состоит из ядра и электронов. Ядро в 10 000 раз меньше атома, но почти вся масса сосредоточена в ядре. Основной характеристикой атомного ядра является то, что оно имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны). Они связаны друг с другом сильным ядерным взаимодействием. Масса протона примерно равна массе нейтрона, но в 1840 раз превышает массу электрона. Протоны и нейтроны имеют в химии общее название — нуклоны. Сам атом электронейтрален.
Атом любого элемента можно обозначить электронной формулой и электронно-графической формулой:
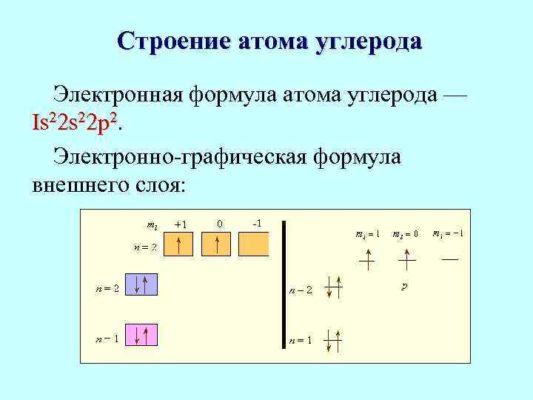
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон – это отрицательно заряженная частица. Электронная оболочка состоит из электронов, движущихся вокруг ядра. Электроны имеют свойство притягиваться к ядру, а между собой на них действует кулоновское взаимодействие. Чтобы преодолеть притяжение к ядру, электроны должны получать энергию от внешнего источника. Чем дальше электрон от ядра, тем меньше энергии ему требуется.
Модели атомов
Долгое время ученые пытались понять природу атома. Древнегреческий философ Демокрит внес большой вклад на раннем этапе. Хотя сейчас его теория кажется нам банальной и слишком простой, в то время, когда идеи об элементарных частицах только начинали зарождаться, к его теории о частицах материи относились совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других свойств атомов. Так, например, огонь, считал он, имеет острые атомы — поэтому огонь горит; У воды гладкие атомы, поэтому она может течь; В твердых предметах, по его мнению, атомы были грубыми.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся как положительно заряженное тело, внутри которого находились электроны с отрицательным зарядом. Эта теория была позднее опровергнута Э. Резерфордом.

Также в 1904 г японский физик Х. Нагаока предложил раннюю планетарную модель атома по аналогии с планетой Сатурн. Согласно этой теории, электроны объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 Э. Резерфорд, проведя ряд экспериментов, пришел к выводу, что атом по строению напоминает планетную систему. Ведь электроны, как и планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречит классической электродинамике. Тогда датский физик Нильс Бор в 1913 году выдвинул постулаты, суть которых заключалась в том, что электрон, находящийся в каких-то особых состояниях, не излучает энергии. Таким образом, постулаты Бора показали, что классическая механика неприменима к атомам. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название планетарной модели Бора-Резерфорда.

Дальнейшие исследования атома привели к созданию такого раздела, как квантовая механика, с помощью которого были объяснены многие научные факты. Современные представления об атоме развились на основе планетарной модели Бора-Резерфорда.
Что мы узнали?
В этой статье по химии (8 класс) кратко и понятно рассказывается о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы материи. Появились разные теории, модели и разные формулы строения атома. Современные представления об атоме основаны на модели Бора-Резерфорда, согласно которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.








Комментирование закрыто