
Кислород (O) – важный газ, необходимый для дыхания, горения и окисления. Относится к группе халькогенов. Самый распространенный элемент на Земле. Строение атома кислорода позволяет ему соединяться с металлами и неметаллами с образованием оксидов.
Строение
По его положению в таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, помещенный в VI группу, второй период. Относительная атомная масса равна 16. Существует три изотопа элемента:
- 160;
- 170;
- 18О.
Самый распространенный – 16О.
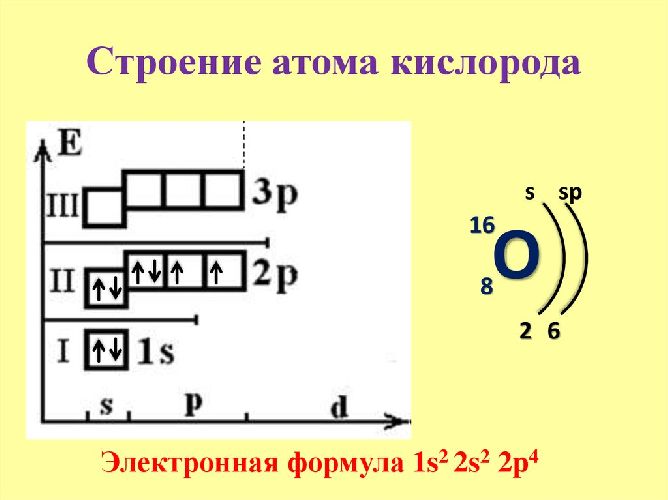
Электронная конфигурация атома кислорода — 1s22s22p4. Ядро атома кислорода имеет заряд +8. Кислород принадлежит к элементам р-семейства. Внешний энергетический уровень содержит шесть валентных электронов. Два спаренных электрона находятся на 2s-орбитали. Уровень 2p содержит два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород обладает второй валентностью.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Физические свойства
Кислород — бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В жидком виде приобретает светло-голубой цвет, в твердом – синий. Занимает 21% атмосферного воздуха.

Кислород поддерживает горение, поэтому его легко обнаружить по тлеющей лучине (вспышке).
Химические свойства
Благодаря своей электронной структуре он имеет высокую степень окисления. Однако он проявляет большую активность при нагревании благодаря прочным двойным связям между атомами. При комнатной температуре бурно реагирует с наиболее активными элементами — щелочными и щелочноземельными металлами, некоторыми неметаллами.
Соединяясь с элементами, он образует оксиды. Окисляет органические вещества. Примеры реакций с простыми веществами:
- К + О2 → К02;
- 3Fe + 202 → Fe3O4;
- S + O2 → SO2.
Кислород реагирует с фосфором, серой, углеродом (графитом) и водородом при нагревании:
- 4П+502 → 2П205;
- С + О2 → SO2;
- С + О2 -> СО2;
- 2Н2 + О2 -> 2Н2О.
Путем быстрого пропускания фтора через щелочь достигается реакция кислорода с фтором:
Кислород напрямую взаимодействует с фтором во время электрического разряда. В этом случае кислород играет роль восстановителя:
Кислород реагирует со сложными веществами и образует оксиды:
- 2CuS + 3O2 → 2CuO + 2SO2;
- 2H2S + 302 → 2S02 + 2H2O;
- 2С6Н6 + 1502 → 12С02 + 6Н2О;
- СН4 + 2О2 → СО2 + 2Н2О.
Кислород не реагирует с золотом и инертными газами. Взаимодействие с галогенами происходит в условиях ультрафиолета или электрического тока.
Что мы узнали?
Кислород – бесцветный газ, распространенный в природе. Схема атомного строения – +8 О)2)6. Кислород всегда имеет валентность II из-за двух неспаренных электронов. Кислород — сильный окислитель, проявляющий в некоторых реакциях свойства восстановителя. Взаимодействует с металлами и неметаллами, сложными неорганическими и органическими веществами. Наиболее активен при нагревании. Не реагирует с благородными газами и золотом.








Комментирование закрыто