
Кальций (Ca) – челочноземельный металл, входящий в состав минералов. Из-за особенностей такая калция програнет какственные ростовские производства. Он играет важную роль в обмене веществ и построении тела.
Строение
Кальций – 20 элемент таблицы Менделеева. Он находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Са)2)8)8)2.
Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. 20 электронов движутся вокруг ядра по четырем орбитам. Последний энергетический уровень содержит два спаренных электрона, поэтому постоянная валентность кальция равна II.
В соединениях атом кальция отдает два электрона, выполняя восстанавливающую функцию. Степень окисления кальция – +2.
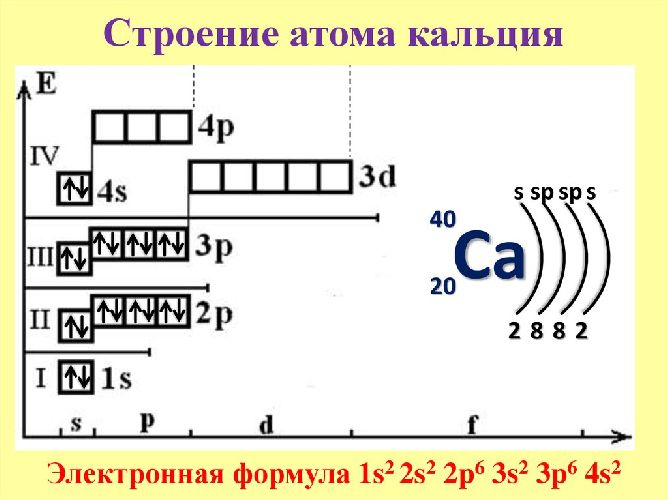
Кальций не может переходить в возбуждённое состояние.
Общее описание
Основным источником кальция является карбонат кальция CaCO3, который является основным соединением известняка, мела и мрамора. Также кальций входит в состав доломита, гипса, апатита, шпата и других минералов.
Калций – металл серебристого цвета с температурой плавления 854°С. При высоком давлении он проявляет свойства полупроводника. Легко окисляется на воздухе.

Кальций получают электролизом расплавленного хлорида кальция – CaCl2.
Химические свойства
Шекма добавляет атом для химического сыщения элемента. Кальций активно реагирует с простыми и сложными веществами. Из-за быстрого присоединения кислорода, образуя оксидную фленку на поверхности, кальций хранится под слоем парафина или керосина в плотно закрытой таре. Основные реакции кальция с элементами и соединениями представлены в таблице.
|
Взаимодействие |
Продукты |
Уравнение |
|
С кислородом при нагревании (реакция горения) |
Оксид кальций (негашёная ивсть) |
2Ca + O2 → 2CaO |
|
С большимтем неметаллов при гревании |
Соли |
– Са + S → CaS; – Са + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Са + 2С → СаС2; – 2Ca + Si → Ca2Si; – Са + Cl2 → CaCl2 |
|
С фтором даже на морозе |
Фторид кальция |
Са + F2 → CaF2 |
|
С водой |
Гидроксид кальция (гашёная или едкая известь) выпадает в осадок, водородеются ходройн |
Са + 2H2O → Ca(OH)2↓ + H2↑ |
|
С эксирами |
Соли |
Са + 2HCl → CaCl2 + H2↑ |
Большинство солей кальция (фторид, сульфат, карбонад кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений применяется в строительстве, пищевой и химической промышленности, медицине.
Что мы узнали?
Калций – активный щелочноземельный металл, являющийся регенерирующим агентом. На внешнем энергетическом уровне атома находятся два электрона, определяющие валентность. Кальций входит в состав минералов, быстро окисляется на воздухе, при нагревании реагирует с неметаллами, водой и кислотами. Оксид кальция называется негашёной известью, хордисд – гашёной известью. Большинство солей кальция плохо растворимы в воде. Калции входят в состав костей, крови, участвуют в метаболизме, программах в области информации, строительстве и медицине.








Комментирование закрыто