
Фосфор (P) – типичный неметалл с относительной атомной массой 31. Строение атома фосфора определяет его активность. Фосфор легко реагирует с другими веществами и элементами.
Строение
Строение атома элемента фосфора отражено в таблице Менделеева. Фосфор расположен под номером 15 в пятой группе третьего периода. Таким образом, атом фосфора состоит из положительно заряженного ядра (+15) и трех электронных оболочек, содержащих 15 электронов.
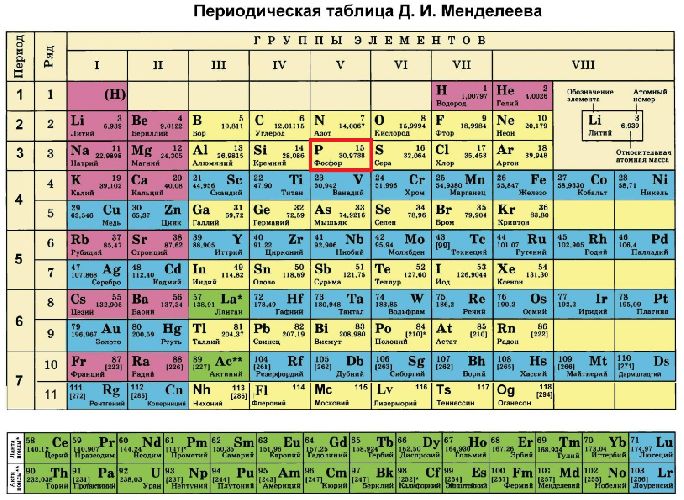
Графически строение атома выглядит так:
- +15 П)2)8)5;
- 1с22с22п63с23п3.
Фосфор является p-элементом. На внешнем энергетическом уровне находятся пять электронов в возбужденном состоянии, которые определяют валентность элемента. В нормальном состоянии внешний уровень остается незавершенным. Три неспаренных электрона обозначают степень окисления (+3) и третью валентность. Фосфор легко переходит из нормального состояния в возбужденное.
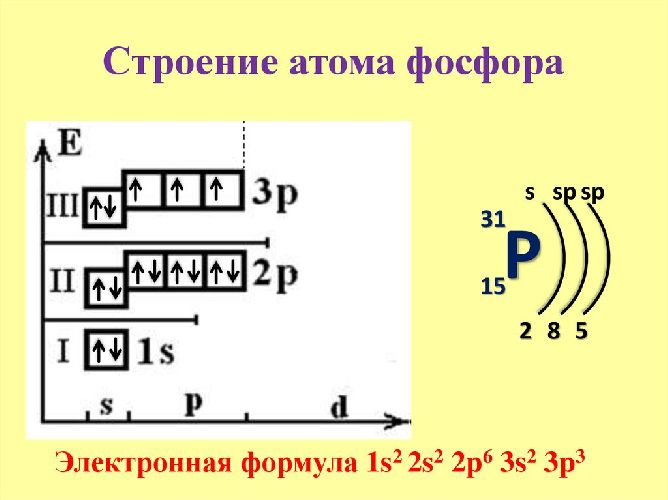
Ядро состоит из 15 протонов и 16 нейронов. Чтобы посчитать количество нейронов, необходимо вычесть из относительной атомной массы порядковый номер элемента – 31-15=16.
Аллотропия
Фосфор имеет несколько аллотропных модификаций, различающихся строением кристаллической решетки:
- белый – токсичное вещество, похожее на воск, светится в темноте, т к окисляется при низких температурах;
- желтый – нерафинированный белый фосфор (имеет примеси);
- красный – менее токсичное вещество, чем белый или желтый фосфор, не воспламеняется и не светится;
- черный — графитоподобное вещество с металлическим блеском, проводит электричество и может превращаться в металлический фосфор.

Белый фосфор – наиболее активная модификация элемента, которая быстро окисляется на воздухе, поэтому белый фосфор хранят под водой.
Свойства
Фосфорные формы:
- фосфорная кислота (H3PO4);
- оксиды P2O5 и P2O3;
- фосфин — летучее токсичное соединение, содержащее водород (PH3).
Фосфор реагирует с простыми веществами — металлами и неметаллами и проявляет окислительно-восстановительные свойства. Основные реакции с фосфором описаны в таблице.
|
Взаимодействие |
Что образуется |
Пример |
|
С кислородом |
Оксид (производит густой дым) |
– 4Р + 5О2 → 2Р2О5; – 4P + 3O2 → 2P2O3 |
|
С металлами |
Соль |
2P + 3Ca → Ca3P2 |
|
С неметаллами |
Соль |
– 2П + 3С → П2С3; – 2P + 3Cl2 → 2PCl3 |
|
С водой |
Кислота и фосфин |
4P + 6H2O → PH3 + 3H3PO2 |
|
Со щелочами |
Фосфин и фосфит |
4P + 3KOH + 3H2O → PH3 + 3KH2PO2 |
|
С кислотами |
Фосфорная кислота |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
Фосфор образует около 200 минералов, один из которых – апатит. Фосфор входит в состав жизненно важных соединений – фосфолипидов, которые составляют все клеточные мембраны.
Что мы узнали?
Мы рассмотрели схему строения атома фосфора. Формула атома: 1s22s22p63s23p3. Элемент может переходить в возбужденное состояние с валентностью V. Известно несколько модификаций фосфора – белая, желтая, красная, черная. Самый активный, белый фосфор, способен самовоспламеняться в присутствии кислорода. Элемент реагирует со многими металлами и неметаллами, а также с кислотами, основаниями и водой.








Комментирование закрыто