
Алюминий (Al) – легкий металл, занимающий третье место по распространенности в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддается литью, литью и механическому воздействию.
Строение
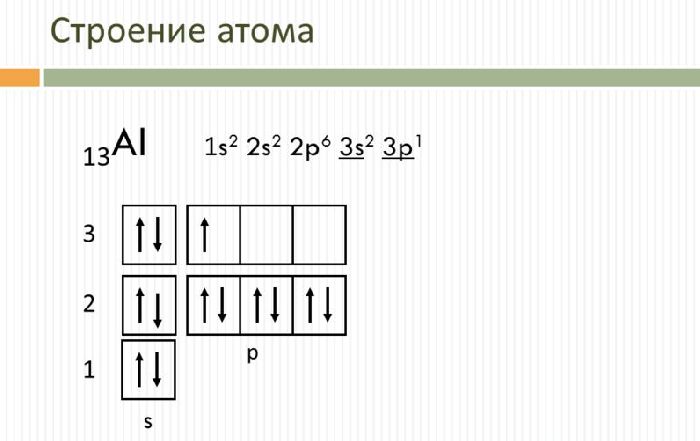
Электронное строение атома элемента алюминия связано с его положением в таблице Менделеева. Алюминий имеет 13-й порядковый номер и находится в третьем периоде, в группе IIIа. Относительная атомная масса алюминия 27. Электронная конфигурация атома алюминия 1s22s22p63s23p1, модель распределения электронов +13Al)2)8)3.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трех электронных оболочек с 13 электронами. На внешнем энергетическом уровне всего три электрона. В возбужденном состоянии атом способен отдать все три электрона, проявить степень окисления +3 или образовать три ковалентные связи. Следовательно, алюминий имеет третью валентность.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл с высокой электропроводностью и пластичностью. При комнатной температуре элемент легко соединяется с кислородом, образуя на поверхности оксидную пленку, защищающую металл от коррозии. Образование пленки предотвращает реакцию с водой, концентрированной азотной и серной кислотами, поэтому для перевозки этих кислот подходят алюминиевые контейнеры.

Для удаления оксидной пленки применяют соли аммония, горячие щелочи и ртутные сплавы. После разрушения оксидной пленки алюминий вступает в реакцию со многими неметаллами и соединениями. Важнейшие химические свойства элемента описаны в таблице.
|
Взаимодействие |
Ход реакции |
Пример |
|
С водой |
Только при отсутствии оксидной пленки. Гидроксид алюминия образуется |
2Al + 6H2O → 2Al(OH)3 + 3H2 |
|
С кислородом |
Оксид алюминия образуется |
4Al + 3O2 → 2Al2O3 + Q |
|
С галогенами |
При комнатной температуре. С йодом – при наличии катализатора |
2Al + 3Cl2 → 2AlCl3 |
|
С серой |
При температуре выше 200°С образуется сульфид алюминия |
2Ал + 3С → Ал2С3 |
|
С фосфором |
При температуре 500°С образуется фосфид алюминия |
Ал + П → АлП |
|
С азотом |
При температуре 800°С образуется нитрид алюминия |
2Ал + Н2 → 2АлН |
|
С углеродом |
При температуре 2000°С образуется карбид алюминия |
4Ал + 3С → Ал4С3 |
|
С кислотами |
При комнатной температуре реагирует с разбавленными кислотами, а при нагревании — с концентрированными. Соли образуются |
– 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
|
Со щелочами |
Растворы и сплавы реагируют |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
|
С оксидами |
Вытесняет металлы |
2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Что мы узнали?
Атом алюминия содержит 13 электронов. Структурная схема алюминия 1с22с22п63с23п1. Внешний уровень содержит три электрона, которые определяют третью валентность элемента. Алюминий — легкий легкоплавкий металл, который легко вступает в реакцию с кислородом и образует на поверхности оксидную пленку. Благодаря пленке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, а при нагревании — с серой, фосфором, азотом и углеродом.








Комментирование закрыто