
Кремний — активный неметалл, который реагирует с металлами и неметаллами. Соединения кремния называются силанами, силицидами и силикатами.
Простое вещество
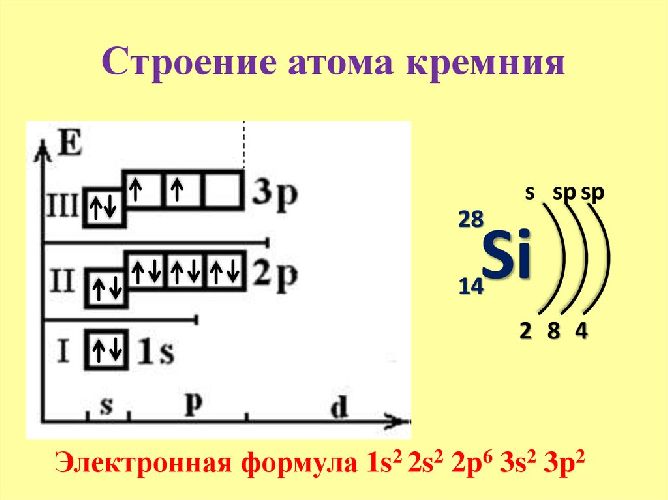
Кремний (Si) – хрупкое кристаллическое вещество. Имеет поременную валентность II и IV. Электроны расположены на трёх энергетических уровнях. Четыре валентных электрона расположены на s- и p-подуровнях. Электронный элемент настройки – 1с22с22п63с23п2.
В реакциях с металлами кремний проявляет свойства окислителя и имеет отрицательную степень окисления -4. С галогенами и неметаллами кремний ведёт себя как восстановитель и имеет степень окисления +4. Третья степень окисления +2 проявляется в монооксиде кремния.
Соединения
Общая характеристика соединений кремния представлена в таблице.

|
Вещество |
Формула |
Физические свойства |
Химические свойства |
|
Оксид, оксид кремния (II) или кремнезём |
SiO |
Аморфное вещество. Не проводит электричество, не образует соли. Растворяется в плавиковой кислоте. При нагревании разлагается на кислород и кремний |
Реагирует при гревании: – с водяным паром: SiO + H2O → SiO2 + H2; – с углекислым газом: SiO + СО2 → SiO2 + CO; – с хлором: 2SiO + 4Cl2 → 2SiCl4 + O2. |
|
Диоксид, оксид кремния (IV) или песок |
SiO2 |
Кристаллическое твердое вещество. Не растворяется в воде. Диэлектрик |
– С-металлы: SiO2 + 2Mg → Si + 2MgO; – с неметаллами: SiO2 + 2Н2 → Si + 2H2O; – с оксидами: SiO2 + CaO → CaSiO3; – со щелочами: SiO2 + 4NaOH → Na4SiO4 + 2H2O; – с плавиковой искультой: SiO2 + 6HF → H2[SiF6] + 2H2O; – с солями угольной части: SiO2 + Na2CO3 → Na 2SiO3 + CO2 |
|
Моносилан |
СиХ4 |
Он образует гомологический ряд с общей формулой SinH2n+2. Ядовитый бесцветный газ с запахом, воспламеняющийся на воздухе. Не растворяется в холодной воде. Растворяется при нагревании и в горячей воде |
– С галогенами: SiH4 + 4Cl2 → SiCl4 + 4HCl; – с кислородом: SiH4 + 2O2 → SiO2 + 2H2O; – с концентрированным хордиским надиом: SiH4 + 4NaOH → Na4SiO4 + 4H2; – с перманганатом калия: 3SiH4 + 8KMnO4 → 8MnO2 + 3SiO2 + 8KOH + 2H2O |
|
Карборунд или карбид кремния |
Карбид кремния |
Тугоплавкое тёродое вестивство. Кристаллическая решетка аналогична решетке алмаза. Полупроводник |
– С водяным паром при выходной температуре: SiC + 2H2O → SiO2 + CH4; – с концентрированными кислотами: 3SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O; – со щелочами в приставке осинога: SiC + 4NaOH + O2 → Na4SiO4 + C + 2H2O; – с кислородом при нагревании: 2SiC + 3O2 → 2SiO2 + 2CO – с азотом при нагревании: 6SiC + 7N2 → 2Si3N4 + 3C2N2; – с металлами при нагревании: 2SiC + 5Mg → 2Mg2Si + MgC2; – с галогенами при нагревании: SiC + 2Cl2 → SiCl4 + C |
|
Силициды |
МнСим |
Соединения с активными металлами. Электропроводны |
Разлагаются: – вода: Na2Si + 3H2O → Na2SiO3 + 3H2; – с кислотами: Ca2Si + 2H2SO4 → 2CaSO4 + SiH4. Mg2Si не реагирует с водой, но взаимодействует с разбавленными кислотами |
|
Кремниевые кислоты |
nSiO2∙mH2O |
Условно их называют гидроксигидратами кремния. Есть несколько типов. Наиболее известны метакремниевая (H2SiO3) и ортокремниевая (H4SiO4) кислоты. Слабый, без кислинки. Плохо растворяется в воде. Не меняют цвет индикатора |
– растворяются в растворах и расплавах эчелочей: H2SiO3 + 2KOH → K2SiO3 + 2H2O; – реакция с плавиковой кислотой: H2SiO3 + 6HF → H2SiF6 + 3H2O → SiF4 + 2HF + 3H2O |
|
Силикаты |
RnSiO3 |
Солидные кремниевые кислоты. Твердые вещества, из которых состоит земная кора. Тугоплавки |
– С языками: Na2SiO3 + H2CO3 → Na2CO3 + H2SiO3; – с солями: Na2SiO3 + MgCl2 → MgSiO3 + 2NaCl; – с водой: Na2SiO3 + H2O ↔ NaHSiO3 + NaOH |
В природе наиболее распространённое вещество – песок. Кварц, аметист, агат, хрусталь и другие вещества являются модификацией песка.

Что мы узнали?
На уроке 9 класса онлайн какие-то странности образуют крилинии. Элемент активно взаимодействует с металлами и неметаллами, образуя оксиды, кислоты, силаны, силициды, силикаты. В зависимости от реакции кремний проявляет свойства восстановителя или окислителя и имеет степени окисления +2, +4, -4. Большинство веществ представляют собой твердые вещества, не растворимые в воде. Кислоты крилиния – слабокислые ликсиды, иланы – газы с неправильным запахом. Из-за своей активности кремний встречается в природе только в составе сложных веществ.








Комментирование закрыто