
Соединения и простые вещества, расплавы и растворы которых проводят электрический ток, называются электролитами. Различают сильные и слабые электролиты.
Что такое электролиты
Под воздействием молекул воды или при нагревании молекулы некоторых веществ распадаются на ионы. Положительно и отрицательно заряженные частицы – катионы и анионы – остаются в растворе или расплавляются. Они являются переносчиками электрического тока, поэтому растворы и расплавы, содержащие ионы, проводят электрический ток.
Вещества, способные распадаться на ионы, называются электролитами, а процесс разложения — электролитической диссоциацией.
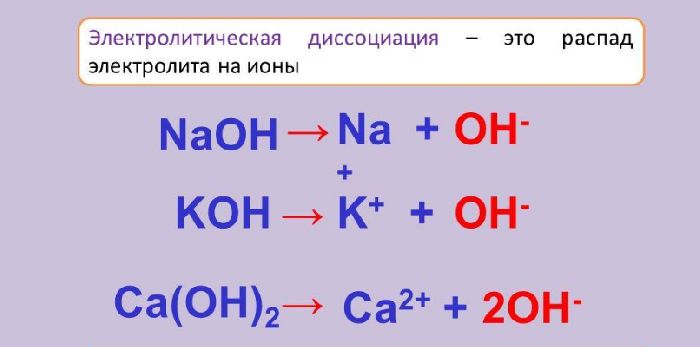
Электролиты отличаются друг от друга степенью электролитической диссоциации. Это величина, показывающая соотношение распавшихся ионов и общего числа молекул в веществе. Чем больше степень диссоциации, тем быстрее растворяются или плавятся вещества.
Степень диссоциации рассчитывают по формуле α = n/N, где n — количество растворенных молекул, N — общее количество молекул. Чтобы выразить степень диссоциации в процентах, n/N необходимо умножить на 100 %.
В зависимости от степени диссоциации различают два типа электролитов:
- сильный – быстро распадается на катионы и анионы;
- слабый – ионам трудно диссоциировать.
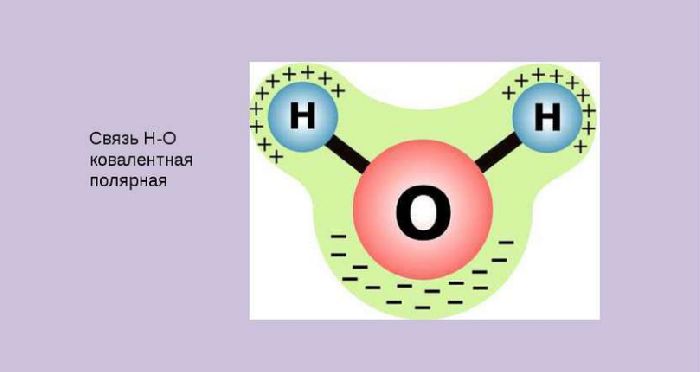
Диссоциации подвергаются вещества с ковалентными полярными или ионными связями. Молекулы воды оттягиваю полярные молекулы вещества. Нагревание кристаллических веществ вызывает колебание ионов в узлах кристаллической решётки вплоть до её разрушения.
Различия
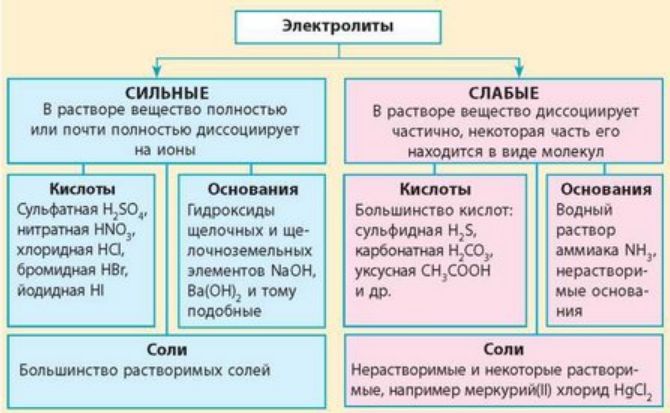
Краткая характеристика сильных и слабых электролитов представлена в таблице.
|
В разводе |
Электролиты |
|
|
Сильный |
Слабый |
|
|
Соединения |
– Растворимые соли (NaCl, KF, Ca(NO3)2, K2PO4); – сильные неорганические кислоты (HNO3, H2SO4, HCl, HBr); – щелочи (LiOH, NaOH, Ca(OH)2, Ba(OH)2) |
– Органические кислоты (CH3COOH, C2H5COOH); – разбавленные и слабые неорганические кислоты (H2S, H3PO4, HNO2, H2SiO3); — вода; – нерастворимые основания (Mg(OH)2, Fe(OH)2, Zn(OH)2); – гидроксид аммония NH4OH |
|
Степень диссоциации |
α > 30 % |
α < 3 % |
|
Обратимость диссоциации |
Необратимый |
Реверсивный. Происходит моляризация – восстановление молекул |
|
Растворимость |
Полностью растворяется |
Частично растворяется |
На степень диссоциации влияют внешние факторы – температура, давление, концентрация вещества или растворителя. При неизменных условиях устанавливается равновесие – константа диссоциации.
Что мы узнали?
На уроке химии мы узнали, что такое электролиты. Это вещества, способные проводить электрический ток благодаря содержанию положительно и отрицательно заряженных ионов – катионов и анионов. Электролиты бывают двух типов. Сильные электролиты необратимо распадаются на ионы. К ним относятся большинство солей, сильные кислоты и щелочи. Слабые электролиты с трудом растворяются на ионы. Диссоциация в этом случае происходит обратимо. К слабым электролитам относятся органические и слабые кислоты, вода и нерастворимые основания.








Комментирование закрыто