
Вещества, которые быстро распадаются на ионы в расплавах или растворах, называются сильными электролитами. К ним относятся растворимые соли, сильные кислоты и щелочи.
Электролитическая диссоциация
Чтобы раствор или расплав проводил электрический ток, необходимо наличие заряженных частиц – ионов. Они растворяются на ионы, т.е вещества, содержащие полярные молекулы, подвергаются электролитической диссоциации. Под воздействием молекул воды или высокой температуры разрушаются ковалентные полярные или ионные связи. В результате образуются катионы – положительно заряженные ионы и анионы – отрицательно заряженные ионы.
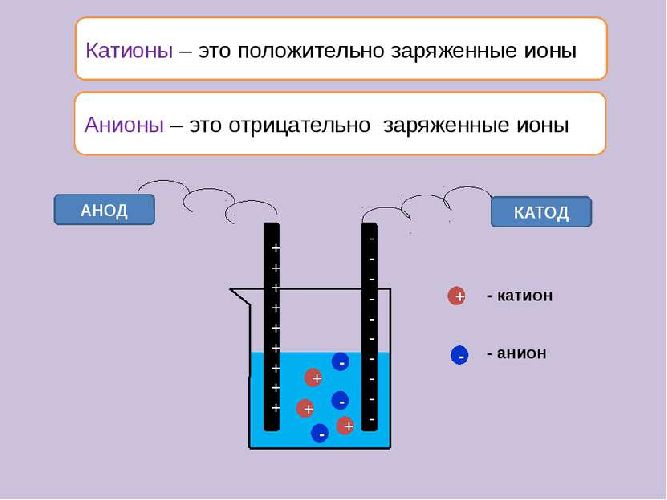
Реакция электролитической диссоциации записывается ионным уравнением:
- HCl → H+ + Cl–;
- КОН → К+ + ОН–;
- Na3P04 → 3Na+ + PO43-.
Скорость реакции и полнота разложения веществ зависят от степени диссоциации. Эта величина показывает, какая часть молекул из общего числа молекул вещества распалась на катионы и анионы. Степень диссоциации определяет, как вещество ведет себя в растворе – растворяется ли оно полностью или частично.
Степень диссоциации зависит от некоторых внешних факторов. Показатель степени можно увеличить, увеличив температуру. В кипящей воде электролит быстрее диссоциирует, молекулы активнее растворяются на ионы. Но с увеличением концентрации вещества уменьшается степень диссоциации. Чем выше концентрация электролита, тем меньше действие растворителя и, следовательно, слабее диссоциация.
Степень диссоциации чаще всего выражают в процентах. Для расчета степени диссоциации используют формулу:
где:
- n — число молекул, разложившихся на катионы и анионы;
- N – общее количество молекул электролита.
Электролиты, молекулы которых быстро и необратимо распадаются на ионы, называются сильными электролитами.
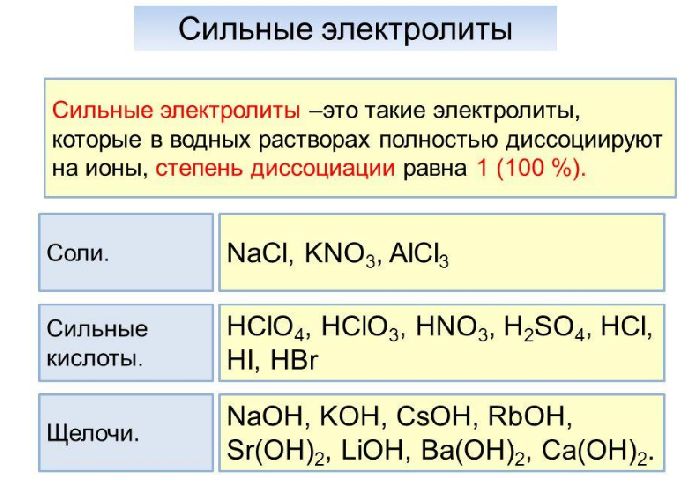
Сильные электролиты
Степень диссоциации сильных электролитов превышает 0,3 или 30%. Они диссоциируют почти полностью. Диссоциация в этом случае необратима.
Список сильных электролитов:
- неорганические соли –
Ca(NO3)2, Na2SO4, NaCl, K2S, AlBr3, Cr2(SO4)3;
- сильные неорганические кислоты –
HCl, HBr, HI, H2SO4, HNO3, HClO4, HMn04;
- гидроксиды щелочных и щелочноземельных металлов (щелочи) –
КОН, RbOH, Са(ОН)2, Sr(ОН)2.
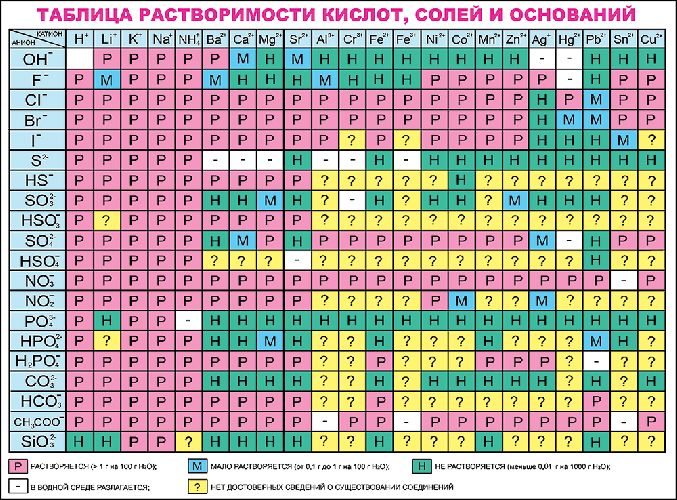
Определить, какая соль относится к сильным электролитам, можно с помощью таблицы растворимости солей. Все растворимые в воде соли – сильные электролиты, малорастворимые и нерастворимые соли – слабые электролиты.
Что мы узнали?
На уроке химии мы узнали, что такое электролитическая диссоциация и какие электролиты считаются сильными. Электролитическая диссоциация характеризуется степенью диссоциации. Чем выше степень диссоциации, тем сильнее распадается электролит. В сильных электролитах степень диссоциации составляет более 30%. К ним относятся сильные неорганические кислоты, растворимые соли и щелочи. На степень диссоциации могут влиять внешние факторы — температура, концентрация, давление.








Комментирование закрыто