
При нагревании сера реагирует с водородом. Образуется ядовитый газ с резким запахом – сероводород. Иначе называется сероводород, сероводород, дигидросульфид.
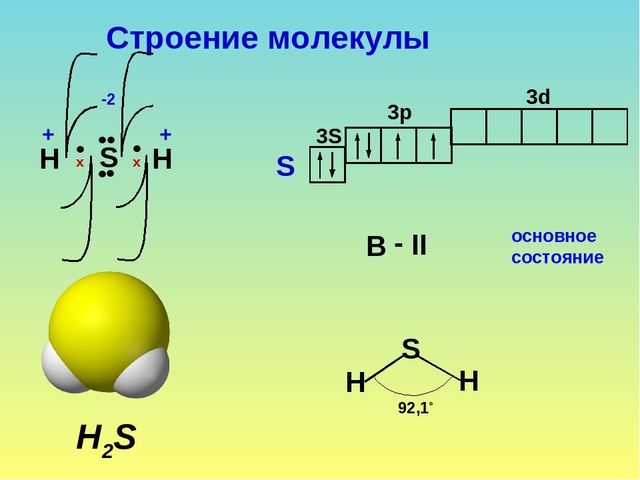
Строение
Сероводород – это бинарное соединение серы и водорода. Формула сероводорода – H2S. Строение молекулы аналогично строению молекулы воды. Однако сера образует с водородом не водородную связь, а ковалентную полярную связь. Это связано с тем, что в отличие от атома кислорода атом серы больше по объему, имеет меньшую электроотрицательность и меньшую плотность заряда.
Получение
Сероводород редко встречается в природе. В небольших концентрациях входит в состав попутных, природных, вулканических газов. Океаны и моря содержат сероводород на больших глубинах. Например, сероводород обнаружен на глубине 200 метров в Черном море. Кроме того, сероводород выделяется при распаде белков, содержащих серу.
В промышленности это достигается несколькими способами:
- реакция кислот с сульфидами:
FeS + 2HCl → FeCl2 + H2S;
- влияние воды на сульфид алюминия:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S;
- плавлением серы с керосином:
С18Н38 + 18S → 18H2S + 18С.
Наиболее чистый газ получается при прямом взаимодействии водорода и серы. Реакция протекает при 600°С.
Физические свойства
Дигидросульфид — бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Это токсичное вещество, опасное в высоких концентрациях. Благодаря своей молекулярной структуре сероводород при обычных условиях не переходит в жидкое состояние.
Общие физические свойства сероводорода:
- плохо растворяется в воде;
- проявляет сверхпроводящие свойства при температуре -70°С и давлении 150 ГПа;
- легковоспламеняющийся;
- растворим в этаноле;
- сжижается при -60,3°С;
- превращается в твердое вещество при -85,6°С;
- плавится при -86°С;
- кипит при -60°С;
- распадается на простые вещества (серу и водород) при 400°С.
При обычных условиях можно приготовить раствор сероводорода (сероводородную воду). Однако сернистый водород не вступает в реакцию с водой. На воздухе раствор быстро окисляется и мутнеет из-за выделения серы. Сероводородная вода проявляет слабые свойства кислоты.

Химические свойства
Сероводород – мощный восстановитель. Важнейшие химические свойства вещества описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
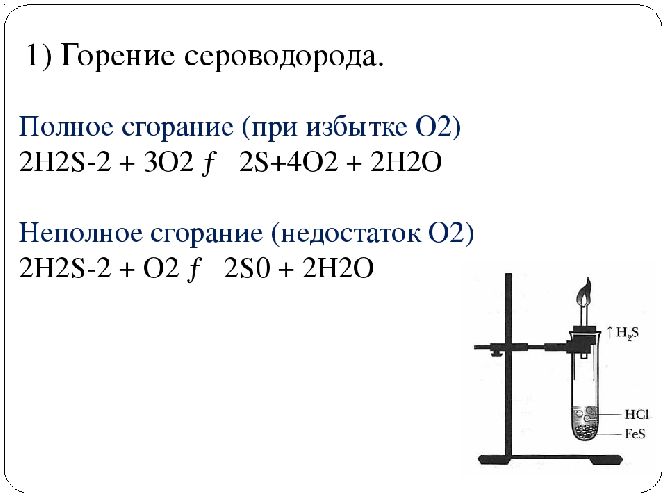
С кислородом |
Горит на воздухе синим пламенем с образованием диоксида серы. При недостатке кислорода образуются сера и вода |
– 2H2S + 4O2 → 2H2O + 2SO2; – 2H2S + O2 → 2S + 2H2O |
|
С окислителями |
Окисляется до диоксида серы или серы |
– 3H2S + 4HClO3 → 3H2SO4 + 4HCl; – 2H2S + SO2 → 2H2O + 3S; – 2H2S + H2SO3 → 3S + 3H2O |
|
Со щелочами |
При избытке щелочи образуются средние соли; при соотношении 1:1 образуются кислые соли |
– H2S + 2NaOH → Na2S + 2H2O; – H2S + NaOH → NaHS + H2O |
|
Диссоциации |
Диссоциирует шаг за шагом в растворе |
– H2S ⇆ H+ + HS–; – HS– ⇆ H+ + S2- |
|
Высокое качество |
Образование черного осадка – сульфида свинца |
H2S + Pb(NO3)2 → PbS↓ + 2HNO3 |
Сернистый водород – токсичный газ, поэтому его применение ограниченно. Большая часть производимого сероводорода используется в промышленной химии для производства серы, сульфида, серной кислоты.
Что мы узнали?
Из темы урока мы узнали о строении, производстве и свойствах сероводорода или сероводорода. Это бесцветный газ с неприятным запахом. Является токсичным веществом. Образует сероводородную воду, не взаимодействуя с водой. В реакциях проявляет свойства восстановителя. Реагирует с кислородом воздуха, сильными окислителями (оксидами, кислородными кислотами) и щелочами. Диссоциирует в растворе в две стадии. Сероводород используется в химической промышленности для получения производных.








Комментирование закрыто