
Типичный неметалл, сера, принадлежит к группе халькогенов и помещен в VI группу таблицы Менделеева. Сера – один из жизненно важных элементов, входящих в состав живых организмов.
Строение
Сера — 16-й элемент таблицы Менделеева, помещенный в VI группу, главную подгруппу и в третий период. Формула серы — S. Относительная атомная масса — 32.
Ядро атома серы имеет положительный заряд +16. Ядро окружают 16 отрицательно заряженных электронов на трех энергетических уровнях.
Электронное строение атома серы 1s22s22p63s23p4. Внешний энергетический уровень содержит шесть валентных электронов. Для завершения p-орбитали не хватает двух электронов, поэтому степень окисления серы равна -2. В соединениях он действует как окислитель, отбирая электроны. Однако способность переходить в возбужденное состояние за счет свободных d-орбиталей дает элементу две дополнительные степени окисления – +4 и +6.
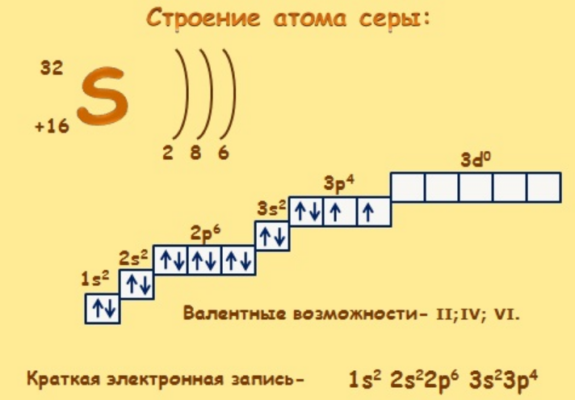
Известно четыре стабильных изотопа серы, находящиеся в природе. Это 32S, 33S, 34S, 36S. Кроме того, искусственно получено 20 радиоактивных изотопов серы.
Аллотропия
Сера – хрупкое желтоватое кристаллическое вещество. При нагревании он плавится и превращается в желтую жидкость. При повышении температуры до 200°С он превращается в вязкую темно-коричневую массу, напоминающую смолу.
Основные физические свойства элемента:
- недостаточная растворимость в воде, входящих в состав сложных веществ;
- плавучесть в воде (не смоченной);
- плохая проводимость тепла и электричества;
- хорошая растворимость в органических растворителях (фенол, бензол, сероуглерод);
- диссоциация на атомы происходит при температуре 1500°С;
- температура кипения – 444,6°С.
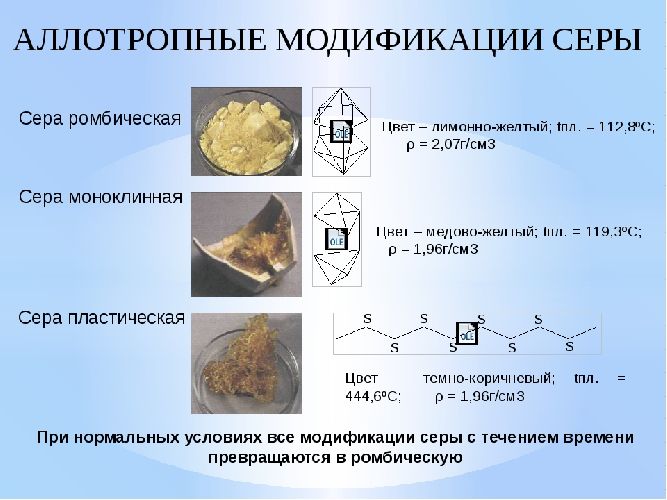
Сера образует аллотропные модификации, различающиеся физическими свойствами. Краткое описание изменений приведено в таблице.
|
Вид |
Формула |
Температура плавления, °С |
Плотность, г/см3 |
Характеристики |
|
Ромбический |
S8 |
113 |
2.07 |
Самая стабильная модификация |
|
Моноклиника |
S8 |
119 |
1,96 |
Стабилен при температуре 96°C и выше. В обычных условиях превращается в ромб |
|
Пластик |
Сн |
119 |
1,96 |
Коричневая вязкая масса. Полимер. Нестабилен, самопроизвольно превращается в ромб |
Свойства
В зависимости от реакции сера проявляет разную степень окисления:
- -2 – в реакциях с металлами и неметаллами (Al2S3, SiS2, Na2S);
- +4 – в реакциях с галогенами и кислородом (SCl4, SBr4, SF4, SO2);
- +6 – в реакциях с элементами, имеющими высокую электроотрицательность (H2SO4, SF6, SO3).
Сера – активное вещество, образующее кислоты, соли и оксиды. Общие химические свойства элемента приведены в таблице.
|
Реакция |
Описание |
Уравнение |
|
С металлами |
В нормальных условиях реагирует только с активными металлами. С остальными реакция протекает при нагревании. Не реагирует с золотом и платиной. Сульфиды образуются |
– 2Na + S → Na2S; – Cu + S → CuS; – Zn + S → ZnS |
|
С неметаллами |
Реагирует с водородом при 150-200°С, с кислородом при 280-360°С. Реагирует с фосфором и углеродом в отсутствие воздуха при нагревании. Реакция с фтором протекает в присутствии катализатора |
– H2 + S → H2S; – S + O2 → SO2; – 2S + 3O2 → 2SO3; – 2П + 3С → П2С3; – 2S + C → CS2; – S + 3F2 → SF6 |
|
С кислотами |
Проявляет свойства восстановителя |
S + 2HNO3 → 2NO + H2SO4 |
|
Диспропорционирование |
Реакция со щелочью образует сульфиды и сульфиты |
3S + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O |
В природе сера находится в составе минералов, горных пород, полезных ископаемых. Например, в составе гипса (CaSO4⋅2H2O), пирита (FeS2), глауберовой соли (Na2SO4⋅10H2O). Серу как продукт метаболизма вырабатывают некоторые бактерии. Сера присутствует в составе белков.

Что мы узнали?
На уроке химии в 9-м классе мы узнали о структурных свойствах и свойствах серы. Это 16-й элемент периодической таблицы, содержащий шесть валентных электронов. Сера проявляет три степени окисления – +4, +6, -2. Элемент образует три модификации — ромбическую, моноклинную, пластичную серу. Реагирует с металлами, неметаллами, кислотами и щелочами. Соли серы с металлами называются сульфидами. Сера входит в состав живых организмов. В природе он встречается в минералах.








Комментирование закрыто