
Обычный сладкий сахар, используемый в повседневной жизни, называется сахарозой. Это олигосахарид, принадлежащий к группе дисахаридов. Формула сахарозы: C12H22O11.
Строение
Молекула содержит остатки двух циклических моносахаридов — α-глюкозы и β-фруктозы. Структурная формула вещества состоит из циклических формул фруктозы и глюкозы, связанных атомом кислорода. Структурные единицы связаны гликозидной связью, образующейся между двумя гидроксильными группами.
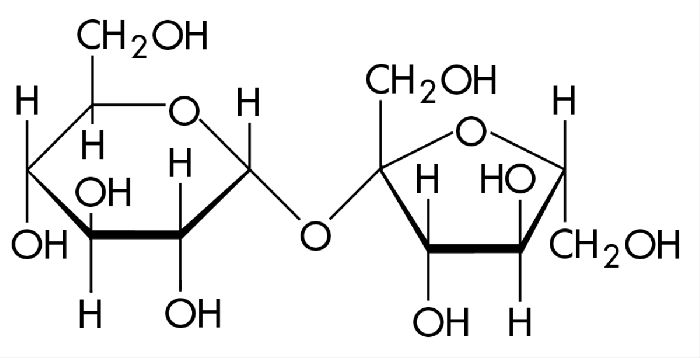
Молекулы сахарозы образуют молекулярную кристаллическую решетку.
Получение
Сахароза – самый распространенный углевод в природе. Соединение содержится во фруктах, ягодах и листьях растений. Большое количество готового вещества содержится в свекле и сахарном тростнике. Следовательно, сахароза не синтезируется, а выделяется посредством физического воздействия, переваривания и очистки.

Натрите свеклу или сахарный тростник на мелкой терке и поместите в большую кастрюлю с горячей водой. Сахарозу вымывают с образованием сахарного раствора. В нем содержатся различные примеси – цветные пигменты, белки, кислоты. Для отделения сахарозы к раствору добавляют гидроксид кальция Ca(OH)2. В результате образуется осадок и сахарат кальция C12H22O11·CaO·2H2O, через который пропускают углекислый газ (углекислый газ). Карбонат кальция выпадает в осадок, а оставшийся раствор выпаривают до образования кристаллов сахара.
Физические свойства
Основные физические свойства вещества:
- молекулярная масса — 342 г/моль;
- плотность – 1,6 г/см3;
- температура плавления – 186°С.

Если расплавленное вещество продолжит нагреваться, сахароза начнет разрушаться и менять цвет. При застывании расплавленной сахарозы образуется карамель – аморфное прозрачное вещество. В нормальных условиях в 100 мл воды растворяется 211,5 г сахара, при 0 °С — 176 г, при 100 °С — 487 г. В 100 мл этанола при нормальных условиях растворяется только 0,9 г сахара.
Попадая в кишечник животных и человека, сахароза быстро расщепляется на моносахариды под действием ферментов.
Химические свойства
В отличие от глюкозы сахароза не проявляет свойств альдегида из-за отсутствия альдегидной группы -СНО. Поэтому качественная реакция «серебряного зеркала» (взаимодействие с аммиачным раствором Ag2O) не происходит. При окислении гидроксидом меди(II) образуется не красный оксид меди(I), а ярко-синий раствор.
Наиболее важные химические свойства описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
Качественная реакция на наличие гидроксильных групп |
Реагирует с гидроксидом меди(II) с образованием ярко-синего сахарида меди |
C12H22O11 + Cu(OH)2 → [Cu(C12H21O11)2] + H2O |
|
Гидролиз |
Реакция происходит при нагревании в присутствии катализатора (серной или соляной кислоты). Сахароза расщепляется на молекулы фруктозы и глюкозы |
С12Н22О11 + Н2О → C6H12O6 + C6H12O6 |
Сахароза не способна окисляться (не является восстановителем в реакциях) и называется невосстанавливающим сахаром.
Применение
Сахар в чистом виде используется в пищевой промышленности для изготовления искусственного меда, сладостей, конфет и алкоголя. Сахарозу используют для получения различных веществ: лимонной кислоты, глицерина, бутанола.
В медицине сахарозу используют для приготовления смесей и порошков для маскировки неприятного вкуса.
Что мы узнали?
Сахароза или сахар – это дисахарид, состоящий из остатков глюкозы и фруктозы. Он имеет сладкий вкус и легко растворяется в воде. Вещество выделяют из свеклы и сахарного тростника. Сахароза менее активна, чем глюкоза. Подвергается гидролизу, реагирует с гидроксидом меди(II), образует сахарид меди и не окисляется. Сахар используется в пищевой, химической промышленности и медицине.








Комментирование закрыто