
Углеводороды, атомы углерода которых соединены одинарными связями, называются насыщенными или насыщенными углеводородами.
Общее описание
К насыщенным углеводородам относятся ациклические (алканы) и карбоциклические (циклоалканы) соединения. Они различаются пространственной структурой и числом атомов.
Ряд веществ, сходных по строению и химическим свойствам, но различающихся числом атомов, называют гомологичными. Вещества, входящие в гомологический ряд, называются гомологами.
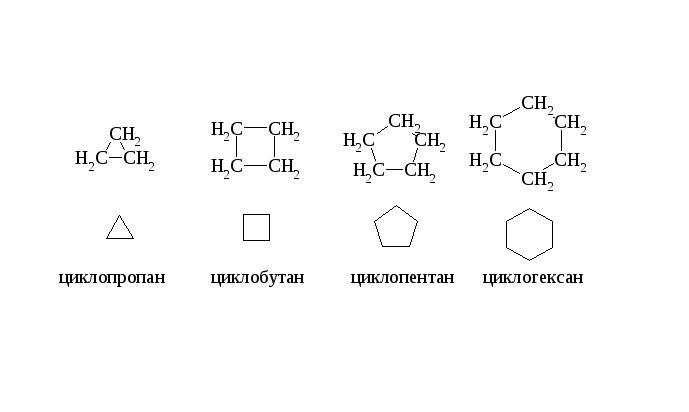
Алканы представляют собой гомологический ряд метана CH4. Циклоалканы или нафтены представляют собой гомологический ряд циклопропана. Общая характеристика предельных углеводородов представлена в таблице.
|
В разводе |
Алканы |
Циклоалканы |
|
Общая формула |
CnH2n+2 |
CnH2n |
|
Молекулярная форма |
Линейный, разветвленный |
Циклический в виде треугольника, квадрата, пятиугольника, шестиугольника |
|
Примеры гомологов |
CH4 – метан |
C3H6 – циклопропан |
|
C2H6 – этан |
C4H8 – циклобутан |
|
|
C3H8 – пропан |
C5H10 – циклопентан |
|
|
C4H10 – бутан |
C6H12 – циклогексан |
|
|
C5H12 – пентан |
C7H14 – циклогептан |
|
|
C6H14 – гексан |
C8H16 – циклооктан |
|
|
C7H16 – гептан |
C9H18 – циклонанан |
|
|
C8H18 – октановое число |
C10H20 – циклодекан |
|
|
C9H20 – нонан |
C11H22 – циклодекан |
|
|
C10H22 — декан |
C12H24 – циклододекан |
Соединения, имеющие одинаковое число атомов, но разное строение, называются изомерами. Все алканы, начиная с бутана, имеют изомеры. К названию добавляется приставка изо- (изобутан, изопентан, изогексан). Формула остается прежней.
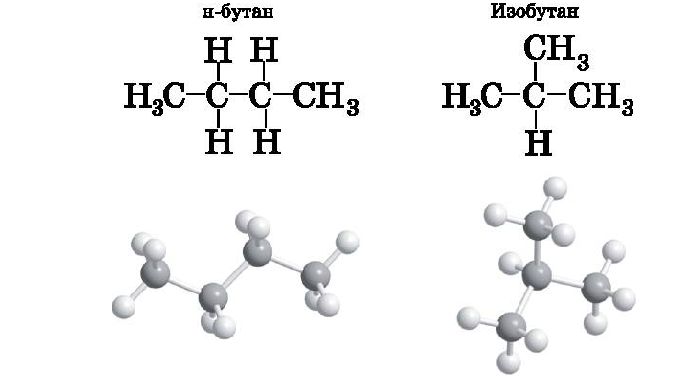
Циклоалканы характеризуются тремя типами изомерии:
- пространственный – расположение относительно плоскости цикла;
- углерод – присоединение дополнительных групп к группе СН2;
- межклассовые – образование изомеров с алкенами.
Название вещества меняется в зависимости от добавляемой группы. Например, метилциклопропан имеет циклическую структуру в виде треугольника с присоединенным метилом (СН3). Название «1,2-диметилциклопентан» указывает на циклическую структуру с двумя присоединенными молекулами метила. Цифры указывают, к каким углам пятиугольника присоединен метилен.
В углах фигуры циклоалканов всегда находится группа CH2, поэтому её часто не записывают, а просто рисуют фигуру. Количество углов указывает на количество атомов углерода. Дополнительные группы дописывают к углам через штрих.
Получение
Существуют промышленные и лабораторные методы получения алканов. В промышленности:
- отделение нефти, газа, угля;
- газификация твердого топлива: C + 2H2 → CH4.
В лаборатории:
- гидролиз карбида алюминия:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4;
- реакция замещения:
2CH3Cl + 2Na → CH3-CH3 + 2NaCl;
- реакция обмена:
CH3COONa + NaOH → Na2CO3 + CH4.
Циклоалканы получают путем выделения из природных источников – нефти, газа, а также путем дегидрирования алканов и гидрирования аренов:
- С6Н14 ↔ С6Н12 + Н2;
- С6Н6 + 3Н2 -> С6Н12.
Свойства
Алканы и циклоалканы имеют схожие химические свойства. Это малореактивные вещества, вступающие в реакцию только при дополнительных условиях – нагревании, давлении. Реакции предельных углеводородов:
- горение:
СН4 + 2О2 → СО2 + 2Н2О + Q;
- замещение (например, галогенирование):
СН4 + Cl2 → CH3Cl + HCl;
- присоединение:
С6Н12 + Н2 → С6Н14;
- разложение:
С6Н12 -> С6Н6 + 3Н2.

С увеличением молекулярной массы предельных углеводородов и, соответственно, числа атомов углерода в гомологических рядах увеличивается температура кипения веществ. Циклоалканы кипят и плавятся при более высоких температурах, чем алканы. Метан, этан, пропан, бутан – газы. Вещества, в состав которых входит 5-15 атомов углерода (с C5H12 по C15H32) – жидкости. Вещества, содержащие более 15 атомов углерода, – находятся в твёрдом состоянии.
Что мы узнали?
Вещества со схожими свойствами — алканы и циклоалканы — относят к предельным углеводородам. Алканы – соединения с линейной молекулярной структурой, циклоалканы – циклические углеводороды, образующие треугольные, квадратные, пятиугольные структуры. Насыщенные углеводороды получают из полезных ископаемых, а также промышленным или лабораторным способом. Это малоактивные вещества, которые вступают в реакции замещения, присоединения, горения и разложения только при дополнительных условиях.








Комментирование закрыто