
Водород практически не встречается в природе в чистом, несвязанном виде. В небольших количествах он может выделяться при извержении вулкана или из скважин при добыче нефти (в земной коре содержится только 1%). Поэтому существуют искусственные методы получения водорода в промышленности.
Методы выделения
Водород — легкий бесцветный газ, занимающий первую ячейку таблицы Менделеева. Газ не ядовит, но легковоспламеняем и взрывоопасен. Это самый распространенный элемент во Вселенной.
С водородом химические элементы легко образуют нестабильные связи, которые легко разрушаются, например, при нагревании.
В промышленности водород выделяется:
- из метана;
- воды;
- из гидридов.
В лабораторных условиях водород получают путем реакции металла с кислотой. Кроме того, водород образуется при взаимодействии водяного пара с металлами и неметаллами, а также при электролизе воды.
Основные способы получения водорода описаны в таблице.
|
Взаимодействие |
Получает реакцию |
Побочные продукты |
|
Натрий с водой |
2Na + 2H2O → 2NaOH + H2↑ |
Гидроксид натрия |
|
Гидрид кальция с водой |
CaH2 + 2H2O → Ca(OH)2 + 2H2↑ |
Гидроксид кальция |
|
Гидрид натрия с водой |
NaH + H2O → NaOH + H2↑ |
Гидроксид натрия |
|
Отпаривание горячим утюгом |
4H2O + 3Fe → Fe3O4 + 4H2↑ |
Оксид железа (II, III |
|
Пар с горячим коксом (газификация угля) |
H2O + C → CO↑ + H2↑ |
Монооксид углерода |
|
Метан с паром (разложение метана при 1000°С) |
CH4 + H2O → CO↑ + 3H2↑ |
Монооксид углерода |
|
Фиолетовый фосфор и водяной пар |
2P + 8H2O → 2H3PO4 + 5H2↑ |
Фосфорная кислота |
|
Цинк с разбавленной соляной кислотой |
Zn + 2HCl → ZnCl2 + H2↑ |
Хлорид цинка |
|
Алюминий или кремний с щелочью и водой |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Si + 2KOH + H2O → Na2SiO3 + 2H2↑ |
Натриевая соль тетрагидроксиалюмината или метасиликат натрия |
|
Разложение метана при высокой температуре |
СН4 → С + 2H2↑ |
Сладкий |
|
Окисление метана |
2CH4 + O2 → 2CO + 4H2↑ |
Монооксид углерода |
|
Электролитический метод расщепления воды (добавление электролитов, например КОН) |
2H2O → 2H2↑ + O2↑ |
Кислород |
|
Электролиз растворов солей |
2NaCl + 2H2O → 2NaOH + Cl2 + H2↑ |
Гидроксид натрия и свободный хлор |
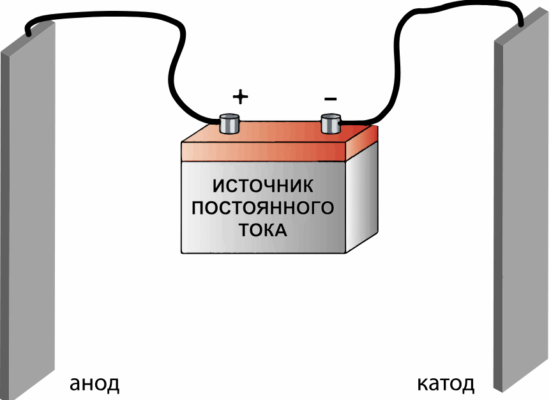
Водород при взаимодействии с кислотами и металлами, содержащими примеси, получается загрязнённым, поэтому проводят процесс очистки. Для этого полученное водородное соединение пропускают через раствор перманганата или бихромата калия, а затем через раствор гидроксида калия и концентрированную серную кислоту.
Использование водорода
Реакции сбора и распознавания водорода необходимы для извлечения чистого газа, который используется в качестве экологического топлива, а также участвует в различных химических реакциях с образованием соединений.
Водород используется в различных отраслях промышленности:
- при производстве аммиака (NH3);
- для производства соляной кислоты (HCl);
- при синтезе метилового спирта;
- для переработки металла;
- при сварке (в результате взаимодействия водорода и кислорода выделяется большое количество тепла);
- для получения растительного жира при производстве маргарина.
Водород использовался для наполнения воздушных шаров и аэростатов. Сегодня сжиженный водород – топливо для ракет.

Что мы узнали?
С 9 класса мы узнали, как получают водород в промышленных и лабораторных условиях. Водород выделяется при реакциях металлов, гидридов, фосфора с водой, при газификации угля, при взаимодействии цинка с соляной кислотой и алюминия или кремния со щелочами. Водород получают из метана путем окисления, разложения при высоких температурах или при взаимодействии с водой. Водород выделяется также при электролизе солей и разложении воды.








Комментирование закрыто