
Многие исследователи предпринимали попытки систематизировать химические элементы. Но только в 1869 году Д. И. Менделееву удалось создать классификацию элементов, установившую связь и зависимость химических веществ и заряда атомного ядра.
История
Современная формулировка периодического закона такова: свойства химических элементов, а также формы и свойства соединений элементов периодически зависят от заряда ядра атомов элемента.
На момент открытия закона было известно 63 химических элемента. Однако атомные массы многих из этих элементов были определены неверно.
Сам Д. И. Менделеев в 1869 году сформулировал свой закон как периодическую зависимость атомных масс элементов, поскольку наука в XIX веке еще не располагала сведениями о строении атома. Однако гениальная дальновидность ученого позволила глубже всех его современников понять закономерности, определяющие периодичность свойств элементов и веществ. Он учел не только увеличение атомной массы, но и уже известные свойства веществ и элементов, и, исходя из идеи периодичности, смог точно предсказать существование и свойства неизвестных ранее элементов и веществ наука, развивавшаяся в то время, корректировала атомные массы ряда элементов и правильно располагала элементы в системе, оставляя пустые места и переставляя их.

Существует миф, что периодическая система приснилась Менделееву. Однако это только красивая история, которая не является доказанным фактом.
Структура периодической системы
Периодическая таблица химических элементов Д. И. Менделеева является графическим отражением его собственного закона. В таблице элементы расположены по определенному химическому и физическому значению. По расположению элемента можно определить его валентность, количество электронов и многие другие характеристики. Таблица разделена по горизонтали на большие и малые периоды, а по вертикали на группы.
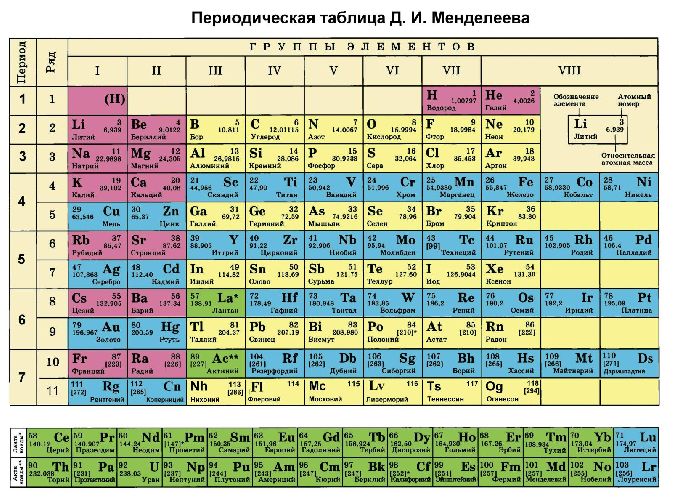
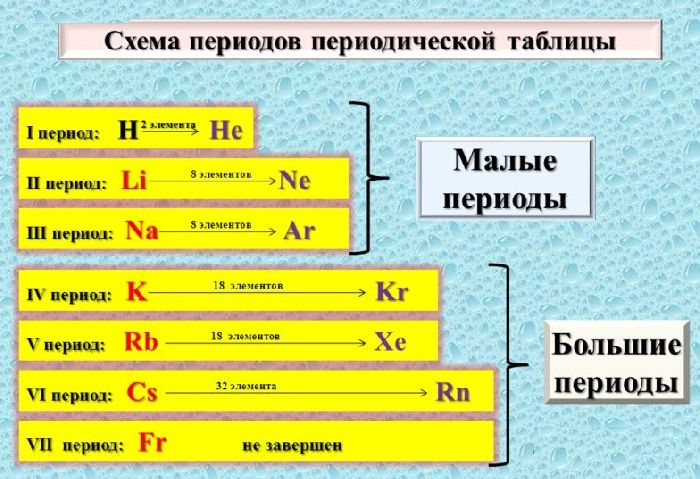
Существует 7 периодов, которые начинаются с щелочного металла, а заканчиваются веществами, имеющими неметаллические свойства. Группы, в свою очередь, состоящие из 8 столбцов, поделены на главные и побочные подгруппы.
Дальнейшее развитие науки показало, что периодическое повторение свойств элементов через определенные промежутки времени, особенно ярко проявляющееся во втором и третьем малых периодах, объясняется повторением электронной структуры внешних энергетических уровней, где находятся валентные электроны расположены, благодаря чему в реакциях образуются химические связи и возникают новые вещества. Поэтому в каждой вертикальной группе столбцов имеются элементы с повторяющимися характерными признаками. Это отчетливо проявляется в группах, содержащих семейства высокоактивных щелочных металлов (группа I, основная подгруппа) и негалогенидных металлов (группа VII, основная подгруппа). Слева направо по периоду число электронов увеличивается от 1 до 8, а металлические свойства элементов уменьшаются. Таким образом, металлические свойства тем сильнее выражены, чем меньше электронов находится на внешнем уровне.
Атомные свойства, такие как энергия ионизации, энергия сродства к электрону и электроотрицательность, также периодически возвращаются. Эти величины связаны со способностью атома отдавать электрон с внешнего уровня (ионизация) или удерживать чужой электрон на своем внешнем уровне (сродство к электрону).
Что мы узнали?
Периодический закон и периодическая система химических элементов Д. И. Менделеева, изученные в 9 классе, дали толчок развитию всей мировой науки. Таким образом, сущность периодичности изменения свойств элементов определяется строением их атомов и, в частности, повторением электронной конфигурации (структуры) внешнего электронного уровня.








Комментирование закрыто