
Эфиры – это производные карбоновых кислот или неорганических кислот, в молекуле которых атом водорода в гидроксильной группе заменен радикалом. Эта структура определяет химические свойства сложных эфиров.
Виды
Эфиры карбоновых кислот делятся на три основные группы:
- фруктовые эфиры — жидкости, содержащие не более восьми атомов углерода (С3Н7-СОО-С2Н5 — этиловый эфир масляной кислоты)
- жиры – жидкие (масла) и твердые вещества, включающие 9-19 атомов углерода и содержащие остатки глицерина и жирных кислот;
- воски представляют собой твердые вещества, содержащие 15-45 атомов углерода.
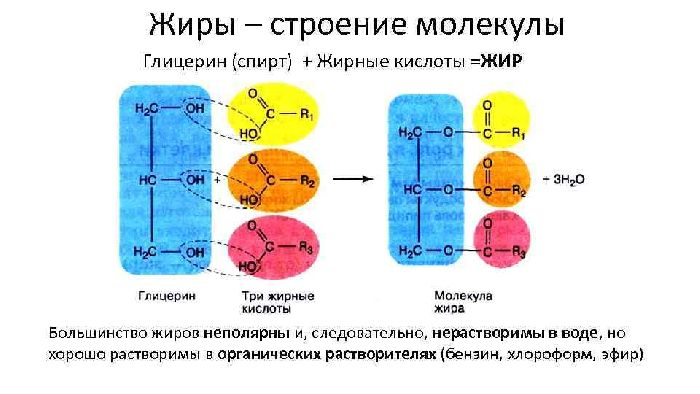
Привычные в быту масла – смеси, состоящие из глицерина и остатков различных жирных кислот.
Получение
Эфиры получают с помощью реакции этерификации спиртов и карбоновых кислот:
Это важнейшая реакция, которая в ряде случаев обратима: при взаимодействии с водой образовавшийся эфир вновь разлагается на исходные вещества.
Эфиры также получают взаимодействием:
- ангидриды со спиртами:
(СН3СО)2О + 2С2Н5ОН → 2СН3СООС2Н5 + Н2О;
- соли карбоновых кислот с галогенированными углеводородами:
CH3(CH2)10COONa + CH3Cl → CH3(CH2)10COOCH3 + NaCl;
- карбоновые кислоты в алкены:
CH3COOH + CH2=CH2 → CH3COOCH2CH3 + H2O.
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.
Химические свойства
Свойства эфиров и жиров обусловлены наличием в молекуле функциональной карбоксильной группы -СООН. Важнейшие химические свойства эфиров представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
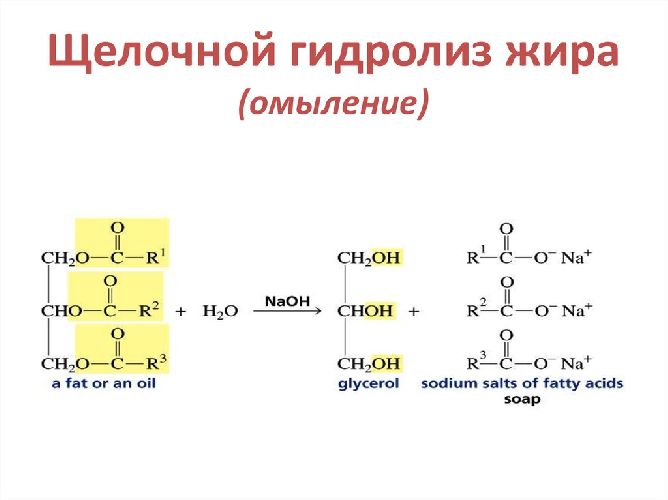
Гидролиз |
Обратная реакция этерификации — расщепление на спирт и кислоту в водной среде. При нагревании с водой в кислой среде они распадаются на кислоту и спирт. Эфиры «омыляются» под действием раствора щелочи, образуя органическую соль и спирт. В этом случае реакция необратима |
|
|
Восстановление (гидрирование) |
При добавлении водорода сложные спирты восстанавливаются до спиртов |
CH3-COO-CH2-CH3 (этилацетат) + 2H2 → 2C2H5OH (этанол) |
|
Присоединение (галогенирование) |
Реакция возможна, если в молекуле имеются двойные связи. Атомы галогенов прикрепляются к местам разрыва связей |
CH3COOCH=CH2 (виниловый эфир уксусной кислоты) + Br2 → Br-CH2-C H(Br)-COOH-CH2 |
|
Замена |
При взаимодействии с аммиаком группа -SON заменяется аминогруппой. Образуются амиды и спирт |
CH3-COO-CH3 (метилацетат) + NH3 → CH3-C(NH2)=O (амид уксусной кислоты) + CH3-OH (метанол) |
|
Горение |
Полное сгорание приводит к образованию углекислого газа и воды |
2CH3-COO-CH3 + 7O2 → 6CO2 + 6H2O |
Сложные эфиры применяются в качестве ароматизаторов в медицине, парфюмерии, пищевой промышленности. Они входят в состав ягод, фруктов, пчелиного воска.

Что мы узнали?
Эфиры в зависимости от строения бывают жидкими или твердыми. Свойства соединений определяются наличием карбоксильной группы -СООН. Эфиры подвергаются реакциям горения, замещения, присоединения и восстановления. Под действием воды они расщепляются на карбоновые кислоты и спирты (реакция обратной этерификации).








Комментирование закрыто