
Серная кислота – одна из самых сильных кислот, представляющая собой маслянистую жидкость. Химические свойства серной кислоты позволяют широко использовать ее в промышленности.
Общее описание
Серная кислота (H2SO4) обладает характерными свойствами кислот и является сильным окислителем. Это наиболее активная неорганическая кислота с температурой плавления 10°С. Кислота кипит при 296°C, выделяя воду и оксид серы SO3. Он способен поглощать водяной пар, поэтому его применяют для осушки газов.

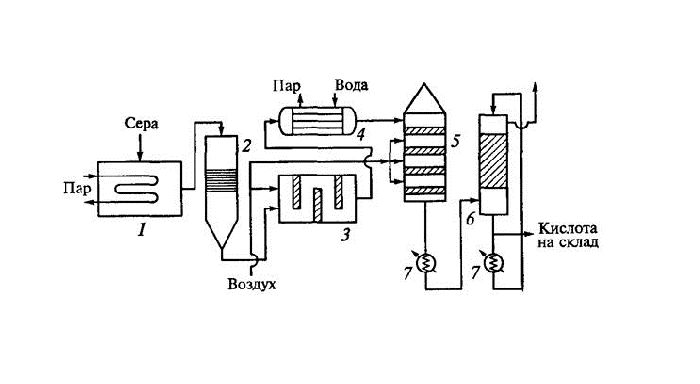
Серную кислоту производят в промышленных масштабах из диоксида серы (SO2), образующегося при горении серы или пирита. Существует два основных способа образования кислоты:
- контактный (концентрация 94%) – окисление диоксида серы до диоксида серы (SO3) с последующим гидролизом:
2S02 + О2 → 2S03; SO3 + H2O → H2SO4;
- азотистый (концентрация 75%) – окисление диоксида серы диоксидом азота при взаимодействии воды:
SO2 + NO2 + H2O → H2SO4 + NO.
Раствор SO3 в серной кислоте называется олеумом. Его также используют для производства серной кислоты.
Реакция с водой способствует выделению большого количества тепла. Поэтому к воде примешивают кислоту, а не наоборот. Вода легче кислоты, она остаётся на поверхности. Если добавить воду в кислоту, вода мгновенно закипит, что приведёт к разбрызгиванию кислоты.
Свойства
Серная кислота образует два типа солей:
- кислоты – гидросульфаты (NaHSO4, KHSO4);
- среда – сульфаты (BaSO4, CaSO4).
Химические свойства концентрированной серной кислоты представлены в таблице.
|
Реакция |
Что образуется |
Пример |
|
С металлами |
— Соль; — вода; — оксид серы; — сера; — сероводород |
– При активном: 2H2SO4 + Mg → MgSO4 + SO2 + 2H2O – с металлами средней активности: 4H2SO4 + 2Cr → Cr2(SO4)3 + 4H2O + S; – с низкой активностью: 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O |
|
С неметаллами |
— Кислота; — вода; – оксид серы |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
|
С оксидами |
— Соль; — вода; – оксид серы |
– Металлы: H2SO4 + CuO → CuSO4 + H2O; – неметаллы: H2SO4 + CO → CO2 + SO2 + H2O |
|
С причинами |
— Соль; — вода |
H2SO4 + 2NaOH → Na2SO4 + 2H2O |
|
С солями |
— Соль; — углекислый газ; — вода; — кислота |
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O Качественная реакция: H2SO4 + BaCl2 → BaSO4 (белый осадок) + 2HCl |
|
Окисление сложных веществ |
– Свободные галогены; — оксид серы; — вода |
H2SO4 + 2HBr → Br2 + SO2 + 2H2O; H2SO4 + 2HI → I2 + 2H2O + SO2 |
|
Карбонизация сахаров (целлюлозы, крахмала, глюкозы) |
– оксид серы; — углекислый газ; — вода |
C6H12O6 + 12H2SO4 → 18H2O + 12SO2↑ + 6CO2↑ |

Разбавленная кислота не окисляет малоактивные металлы, входящие в электрохимический ряд после водорода. При взаимодействии с активными металлами (литием, калием, натрием, магнием) выделяется водород и образуется соль. Концентрированная кислота при нагревании проявляет окислительные свойства по отношению к тяжелым, щелочным и щелочноземельным металлам. Реакции с золотом и платиной нет.
Серная кислота (разведённая и концентрированная) на холоде не взаимодействует с железом, хромом, алюминием, титаном, никелем. Благодаря пассивации металлов (образования защитной оксидной плёнки) серную кислоту можно перевозить в металлических цистернах. Оксид железа разрушается при нагревании.
Что мы узнали?
С 9 класса мы узнали о свойствах серной кислоты. Это мощный окислитель, вступающий в реакцию с металлами, неметаллами, органическими соединениями, солями, основаниями и оксидами. При взаимодействии с водой выделяется тепло. Серную кислоту получают из оксида серы. Концентрированная кислота не взаимодействует с некоторыми металлами без нагревания, что позволяет транспортировать кислоту в металлической таре.








Комментирование закрыто