
Химические свойства щелочных и щелочноземельных металлов схожи. Внешний энергетический уровень щелочных металлов имеет один электрон, а щелочноземельных — два. В ходе реакций металлы легко разделяются валентными электронами, проявляя свойства сильного восстановителя.
Щелочные
В I группу таблицы Менделеева входят щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- французский

Они отличаются мягкостью (можно резать ножом), низкой температурой плавления и кипения. Это самые активные металлы.
Химические свойства щелочных металлов представлены в таблице.
|
Реакция |
Характеристики |
Уравнение |
|
С кислородом |
Они быстро окисляются на воздухе. Литий образует оксид при температуре выше 200°C. Натрий образует смесь 80% пероксида (R2O2) и 20% оксида. Другие металлы образуют супероксиды (RO2) |
– 4Li + O2 → 2Li2O; – 2Na + О2 → Na2O2; – Rb + O2 → RbO2 |
|
С азотом |
Только литий реагирует при комнатной температуре |
6Li + N2 → 2Li3N |
|
С галогенами |
Реакция мощная |
2Na + Cl2 → 2NaCl |
|
С неметаллами |
При нагреве. Они образуют сульфиды, гидриды, фосфиды и силициды. Только литий и натрий реагируют с углеродом с образованием карбидов |
– 2К + С → К2С; – 2Na + H2 → 2NaH; – 2Cs + 5P → Cs2P5; – Rb + Si → RbSi; – 2Li + 2C → Li2C2 |
|
С водой |
Только литий реагирует спокойно. Натрий горит желтым пламенем. Калий реагирует мгновенно. Цезий и рубидий взрываются |
2Na + 2H2O → 2NaOH + H2↑ |
|
С кислотами |
Они бурно реагируют с соляной кислотой, фосфорной кислотой и разбавленной серной кислотой. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образуется оксид азота (I), с разбавленной азотной кислотой — азот |
– 2Na + 2HCl → 2NaCl + H2; – 8Na + 5H2SO4 (концентрированная) → 4Na2SO4 + H2S↑ + 4H2O; – 8К + 10HNO3 (концентрированная) → 8KNO3 + N2O + 5H2O; – 10Na + 12HNO3 (разбавленный) → N2 + 10NaNO3 + 6H2O |
|
С аммиаком |
Формируют амины |
2Li + 2NH3 → 2LiNH2 + H2↑ |
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
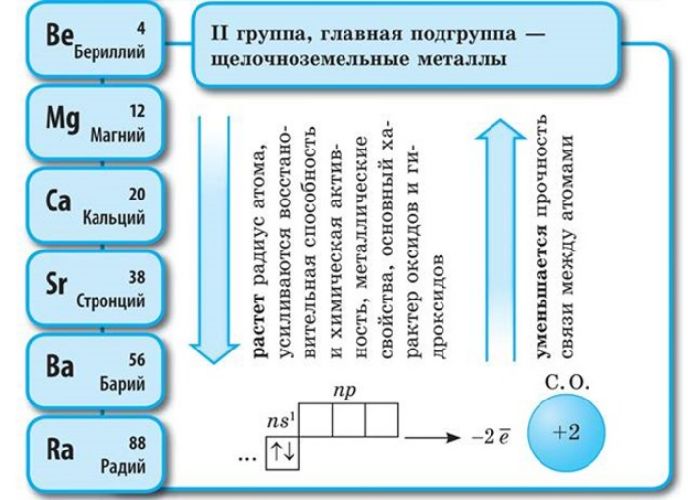
В отличие от щелочных металлов, они тверже. Ножом можно разрезать только стронций. Самый плотный металл — радий (5,5 г/см3).
Бериллий реагирует с кислородом только при нагревании до 900°С. Не реагирует с водородом и водой ни при каких условиях. Магний окисляется при температуре 650°С и реагирует с водородом под высоким давлением.
В таблице приведены важнейшие химические свойства щелочноземельных металлов.
|
Реакция |
Характеристики |
Уравнение |
|
С кислородом |
Образуют оксидные пленки. Самовоспламеняется при нагревании до 500°С |
2Mg + O2 → 2MgO |
|
С водородом |
При высоких температурах образуют гидриды |
Ср + Н2 → СрH2 |
|
С галогенами и неметаллами |
Реагирует при нагревании |
– Be + Cl2 → BeCl2; – Mg + S → MgS; – 3Са + 2Р → Са3Р2; – 3Ca + N2 → Ca3N2; – Ва + 2С → ВаС2 |
|
С водой |
При комнатной температуре |
Mg + 2H2O → Mg(OH)2 + H2 |
|
С кислотами |
Все металлы реагируют с образованием солей |
4Ca + 10HNO3 (концентрированная) → 4Ca(NO3)2 + N2O + 5H2O |
|
Со щелочами |
Реагирует только бериллий |
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
|
Замена |
Менее активные металлы замещают оксидами. Исключение составляет бериллий |
2Mg + ZrO2 → Zr + 2MgO |
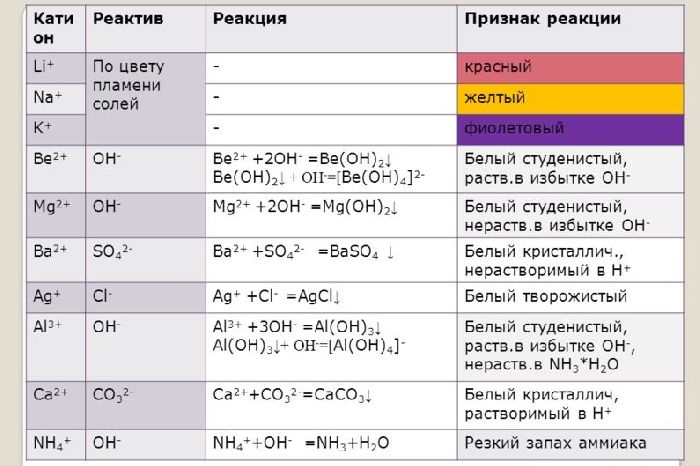
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
Что мы узнали?
Щелочные и щелочноземельные металлы — активные элементы таблицы Менделеева, которые реагируют с простыми и сложными веществами. Щелочные металлы мягче, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуют оксиды, пероксиды, супероксиды, взаимодействуют с кислотами и аммиаком. При нагревании они реагируют с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами и водой. Бериллий не реагирует с водородом и водой, но реагирует со щелочами и кислородом при высоких температурах.








Комментирование закрыто