
Неметаллы – это химические элементы, обладающие типичными неметаллическими свойствами и расположенные в правом верхнем углу таблицы Менделеева. Какие свойства присущи этим элементам и с чем реагируют неметаллы?
Неметаллы: общая характеристика
Неметаллы отличаются от металлов тем, что на внешнем энергетическом уровне у них больше электронов. Поэтому их окислительные свойства более выражены, чем у металлов. Неметаллы характеризуются высокими значениями электроотрицательности и высоким восстановительным потенциалом.
К неметаллам относятся химические элементы, которые находятся в газообразном, жидком или твердом агрегатном состоянии. Так, например, азот, кислород, фтор, хлор, водород – газы; йод, сера, фосфор – твердые; бром – жидкость (при комнатной температуре). Всего существует 22 неметалла.

С увеличением заряда ядра атома наблюдается закономерность изменения свойств химических элементов от металлических к неметаллическим.
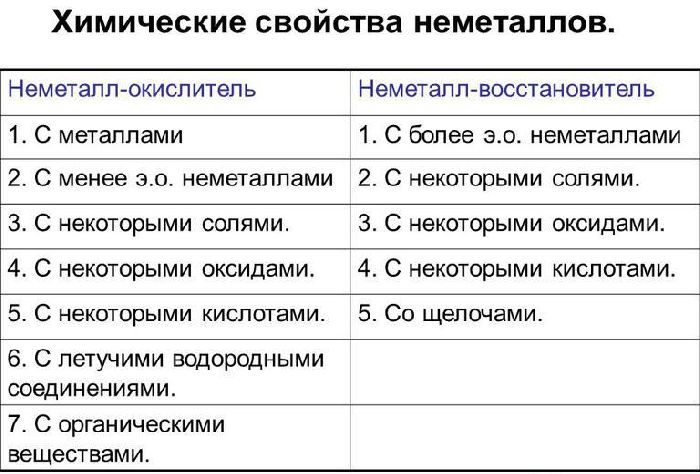
Химические свойства неметаллов
Водородные свойства неметаллов представляют собой в основном летучие соединения, являющиеся кислыми в водных растворах. Они имеют молекулярные структуры, а также ковалентные полярные связи. Некоторые из них, например вода, аммиак или фтороводород, образуют водородные связи. Соединения образуются в результате прямого взаимодействия неметаллов и водорода. Пример:
Все водородные соединения обладают восстановительными свойствами, и их восстановительная способность увеличивается справа налево по периоду и сверху вниз по группе. Так, сероводород горит с большим количеством кислорода:
Окисление может пойти по другому пути. Так, уже на воздухе водный раствор сероводорода мутнеет в результате образования серы:
Соединения неметаллов с кислородом обычно представляют собой кислотные оксиды, соответствующие кислородсодержащим кислотам (оксокислотам). Строение оксидов типичных неметаллов молекулярное.
Чем выше степень окисления неметалла, тем сильнее соответствующая кислородсодержащая кислота. Поэтому хлор не взаимодействует непосредственно с кислородом, а образует ряд оксокислот, соответствующих оксидам и ангидридам этих кислот.
Наиболее известные соли этих кислот — хлорная известь CaOCl2 (смешанная соль хлорноватистой и соляной кислоты), бертоллетовская соль KClO3 (хлорат калия).
Азот в оксидах имеет положительные степени окисления +1, +2, +3, +4, +5. Первые два оксида N2O и NO не солеобразуют и являются газами. N2O3 (оксид азота III) – ангидрид азотной кислоты HNO2. Оксид азота IV — бурый газ, NO2 — газ, хорошо растворяющийся в воде и образующий две кислоты. Этот процесс можно выразить уравнением:

Азотный ангидрид N2O5 — белое кристаллическое вещество, легко растворяющееся в воде. Пример:
Соли азотной кислоты называются нитратами и растворимы в воде. Соли калия, кальция и натрия используются для производства азотных удобрений.
Фосфор образует оксиды со степенями окисления +3 и +5. Наиболее устойчивым оксидом является фосфорный ангидрид Р2О5, образующий молекулярную решетку в узлах, где находятся димеры Р4О10. В качестве фосфорных удобрений применяют соли ортофосфорной кислоты, например аммофос NH4 H2 PO4 (дигидрофосфат аммония).
Таблица расположения неметаллов
| Группа | Я | III | IV | В | МЫ | VII | VIII |
| Первый период | ЧАС | Он | |||||
| Второй период | Б | С | Н | О | Ф | Нет | |
| Третий период | Сказать | П | С | Кл | Год | ||
| Четвертый период | Как | Видеть | Братан | НОК | |||
| Пятый период | Чай | Я | Ксе | ||||
| Шестой период | На | Рн |
Что мы узнали?
В школьной программе химии (8-9 классы) большое внимание уделяется изучению общих свойств неметаллов. В данной статье изучается информация о том, чем металлы отличаются от неметаллов и какими свойствами они обладают. Также приведена таблица химических свойств неметаллов.








Комментирование закрыто