
Металлы являются активными восстановителями с положительной степенью окисления. Благодаря своим химическим свойствам металлы широко используются в промышленности, металлургии, медицине и строительстве.
Активность металлов
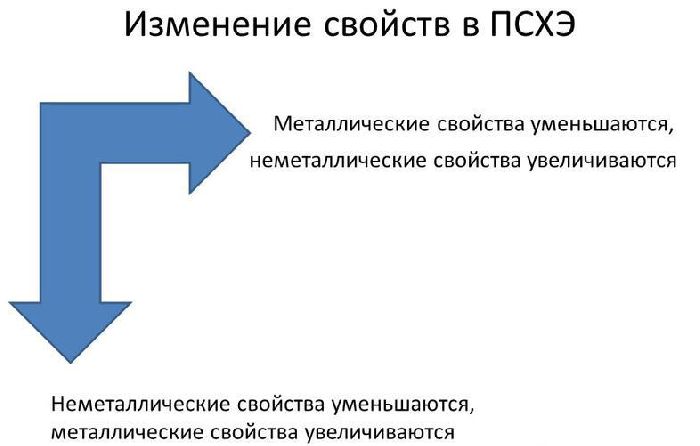
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
Активность простых веществ проявляется в ряду электрохимических напряжений металлов. Слева от водорода расположены активные металлы (активность увеличивается влево), справа неактивные металлы.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе таблицы Менделеева и находящиеся левее водорода в ряду электрохимических напряжений. Они реагируют со многими веществами уже при комнатной температуре. За ними следуют щелочноземельные металлы, которые входят во II группу. Они реагируют с большинством веществ при нагревании. Металлы электрохимического ряда от алюминия до водорода (средняя активность) для вступления в реакции требуют дополнительных условий.

Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагируют только с определенными кислотами, вытесняя водород и образуя соли. Наиболее выраженные двойственные характеристики проявляют:
- алюминий;
- вести;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с различными веществами представлены в таблице химических свойств металлов.
|
Реакция |
Характеристики |
Уравнение |
|
С кислородом |
Большинство металлов образуют оксидные пленки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует перекись (Na2O2), остальные металлы I группы образуют супероксиды (RO2). Щелочноземельные металлы при нагревании самовозгораются, а металлы средней активности окисляются. Золото и платина не взаимодействуют с кислородом |
– 4Li + O2 → 2Li2O; – 2Na + O2 → Na2O2; – К + О2 → КО2; – 4Al + 3O2 → 2Al2O3; – 2Cu + O2 → 2CuO |
|
С водородом |
При комнатной температуре реагируют щелочные соединения, а при нагревании реагируют щелочноземельные соединения. Бериллий не реагирует. Магний также требует высокого кровяного давления |
– Sr + H2 → SrH2; – 2Na + H2 → 2NaH; – Mg + H2 → MgH2 |
|
С азотом |
Только активные металлы. Литий реагирует при комнатной температуре. Прочие металлы — путем нагревания |
– 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
|
С углеродом |
Литий и натрий, остальное — при нагревании |
– 4Ал + 3С → Ал3С4; – 2Li+2C → Li2C2 |
|
С серой |
Золото и платина не взаимодействуют |
– 2К + С → К2С; – Fe + S → FeS; – Zn + S → ZnS |
|
С фосфором |
При нагреве |
3Ca + 2P → Ca3P2 |
|
С галогенами |
Не вступают в реакцию только малоактивные металлы, медь — при нагревании |
Cu + Cl2 → CuCl2 |
|
С водой |
Щелочи и некоторые щелочноземельные металлы. При нагревании, в кислой или щелочной среде, металлы средней активности реагируют |
– 2Na + 2H2O → 2NaOH + H2↑; – Са + 2Н2О → Са(ОН)2 + Н2; – Pb + H2O → PbO + H2↑ |
|
С кислотами |
Металлы слева от водорода. Медь растворяется в концентрированных кислотах |
– Zn + 2HCl → ZnCl2 + 2H2↑; – Fe + H2SO4 → FeSO4 + H2↑; – Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O |
|
Со щелочами |
Только амфотерные металлы |
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
|
С солями |
Активные металлы заменяют менее активные металлы |
3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Применение
Общие химические свойства металлов используются для изготовления сплавов, моющих средств и используются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике и несущих конструкциях.
Наиболее важные области использования перечислены в таблице.
|
Промышленность |
Производство |
Металлы |
|
Химическая индустрия |
Катализаторы, соли, щелочи |
Pt, Fe, Ni, K |
|
Пищевая промышленность |
Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) |
Na, Ca, Ag |
|
Металлургия |
Сплавы, покрытия, детали различной формы, проволока, плакировка, строительные материалы и инструмент |
Fe, Cr, Ni, W, Mo |
|
Инструментарий |
Микросхемы, фотоэлементы, датчики |
Cs, Co, Ni, Cu |
|
Ювелирная промышленность |
Украшения |
Au, Pt, Ag |
|
Лекарство |
Протезы |
Десять, девять, ой |

Что мы узнали?
На уроке химии в 9 классе мы узнали об основных химических свойствах металлов. Способность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он реагирует в обычных условиях. Активные металлы реагируют с галогенами, неметаллами, водой, кислотами и солями. Амфотерные металлы реагируют со щелочами. Низкореактивные металлы не реагируют с водой, галогенами и большинством неметаллов. Мы кратко рассмотрели области использования. Металлы используются в медицине, промышленности, металлургии и электронике.








Комментирование закрыто