
Кремний – твердый неметалл, входящий в состав горных пород. В обычных условиях он инертен, но при нагревании проявляет окислительные и восстановительные свойства. Химические свойства кремния используются в силикатной промышленности для производства стекла, зеркал, электроники и строительных материалов.
Общее описание элемента
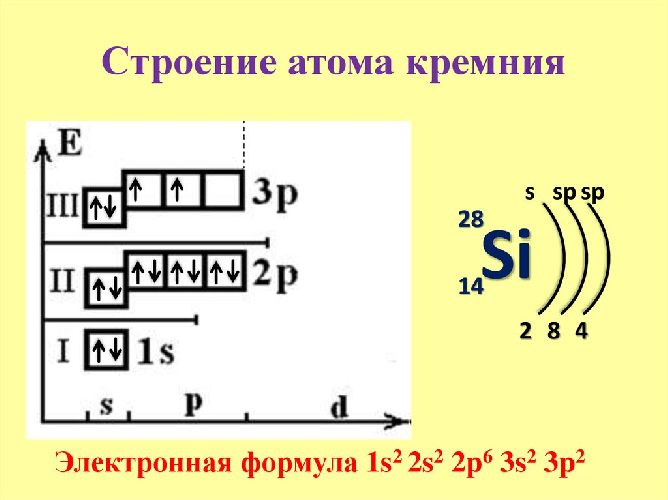
Кремний расположен в четвертой группе и третьем периоде таблицы Менделеева. Ядро атома кремния имеет положительный заряд +14. Вокруг ядра движутся 14 отрицательно заряженных электронов.
Атом может перейти в возбужденное состояние благодаря свободному d-подуровнею. Следовательно, элемент показывает две положительные степени окисления (+2 и +4) и одну отрицательную (-4). Электронная конфигурация – 1с22с22п63с23п2.
Кремний — хрупкий полупроводник с высокими температурами входа и кипения. Относительно легкий неметалл: плотность 2,33 г/см3.
В чистом виде кремний не встречается. Входит в состав песка, кварца, агата, аметиста и других пород.

Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдает электроны. Реакции возможны только при сильном нагревании. В обычных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
|
Элемент |
Описание |
Реакция |
|
Фтор |
В нормальных условиях |
Si + 2F2 → SiF4 |
|
Кислород |
Реагирует при 600°C с образованием диоксида (песка) |
Si + O2 → SiO2 |
|
Хлор |
Реагирует при 400°C |
Si + 2Cl2 → SiCl4 |
|
Углерод |
Реагирует при 2000°C с образованием карборунда |
Si + C → SiC |
|
Азот |
Происходит при 1000°C |
3Si + 2N2 → Si3N4 |
|
Сера |
Реагирует при 1000°C |
Си + 2S → SiS2 |
|
Жизнь |
Реагирует при 2000°C |
Си + 3Б → Б3Си |
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Кремний проявляет окислительные свойства только в реакциях с металлами. При их плавлении образуются соли – силициды:
- Si + 2Mg → Mg2Si;
- Si + 2Ca → Ca2Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi2.
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
С галогеноводородами |
Реагирует с плавиковой кислотой при нормальных условиях, с соляной кислотой — при 300°С, с бромистым водородом — при 500°С |
– Si + 4HF → SiF4 + 2H2; – Si + 4HCl → SiCl4 + 2H2; – Si + 4HBr → SiBr4 + 2H2 |
|
С кислотами |
Он устойчив к кислотам и покрыт оксидной пленкой. Реакция протекает только со смесью азотной и плавиковой кислот |
3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O |
|
Со щелочами |
Растворяется в водных растворах с образованием силикатов и водорода |
Si + 2KOH + H2O → K2SiO3 + H2 |
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.
Что мы узнали?
Кремний – хрупкий неметалл, вступающий в реакцию с металлами, неметаллами и сложными веществами. В реакциях с металлами проявляет свойства окислителя, а с неметаллами – восстановителя. В обычных условиях реагирует только с фтором, плавиковой кислотой (в том числе азотной) и щелочами. Другие реакции протекают при повышенных температурах.








Комментирование закрыто