
Кислоты – сложные вещества, молекулы которых состоят из атомов водорода (которые могут быть заменены атомами металлов), связанных с кислотным остатком. Кислоты бывают органические и неорганические, бескислородные и кислородсодержащие.
Классификация и свойства кислот
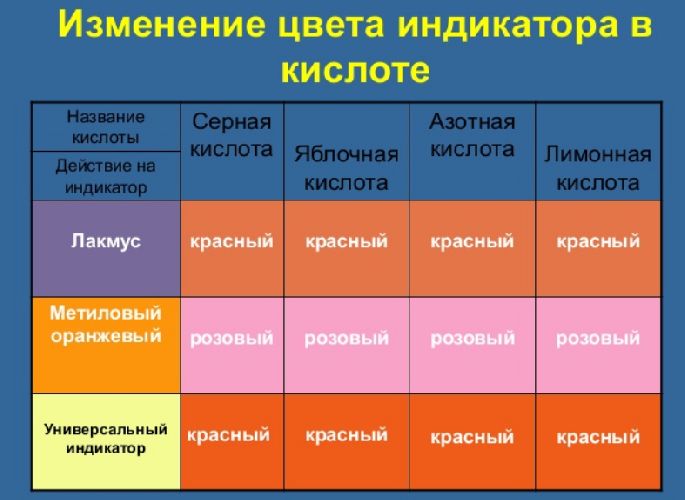
Кислоты бывают жидкие (например H2SO4 – серная кислота) и твердые (например H3PO4 – фосфорная кислота) смеси. Большинство кислот хорошо растворимы в воде. Но есть и нерастворимые, типичный пример – H2SiO3 – кремниевая кислота. Кислоты могут разъедать кожу и ткани. К физическим свойствам кислот относится то, что они меняют цвет индикаторов: лакмус — красный, метилоранж — розовый, фенолфталеин — бесцветный.
С точки зрения теории электролитической диссоциации кислоты представляют собой электролиты, способные диссоциировать в водном растворе с образованием только ионов водорода в качестве катионов. Соответственно, кислоты можно назвать протолитами, то есть веществами, отдающими протон.
По числу атомов водорода, которые могут быть заменены металлом, определяют основность кислоты: одноосновные кислоты — HBr, HClO2; двухосновные – H2SO3, H2S; трехосновные – H3PO4 (ортофосфорная кислота) и др.
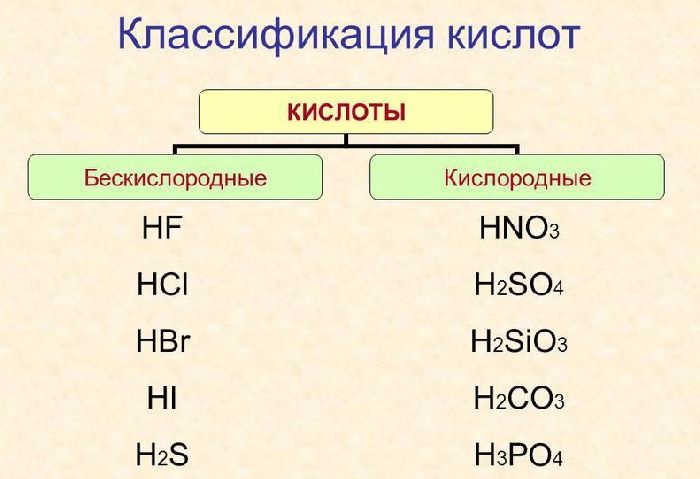
Кислоты делятся на кислородные и бескислородные (примером первой является HNO3, второй – HCl).
Названия бескислородных кислот строятся следующим образом: к корню русского названия неметалла, образующего кислоту, прибавляется буква о и слово «водородная». Например: HCl – хлороводородная кислота, H2S – сероводородная кислота.
Название кислородных кислот образовано от русского названия центрального элемента с добавлением различных суффиксов, характеризующих степень окисления, и слова «кислота». Суффиксы «н» или «ов» соответствуют максимальной степени окисления центрального элемента. По мере уменьшения степени окисления суффиксы изменяются в следующем порядке: -оват-, -ист-, -оватист-. Например: HClO4 – хлорная кислота, HClO3 – хлорноватая кислота, HClO2 – хлорная кислота, HClO – хлористоводородная кислота.
Химические свойства кислот
Кислоты реагируют с основными и амфотерными оксидами, с основаниями и солями:
H2SO4+ZnO=ZnSO4+H2O
H2SO4+Ba(OH)2 =BaSO4 +2H2O
H2SO4+BaCl=BaSO4+2HCl
Металлы, стоящие в ряду стандартных электродных потенциалов левее водорода, вытесняют его из кислот (исключение HNO3, конц. H2SO4), например:
Таблица химических свойств кислот
| Реакция | Примеры |
| Действия по индикаторам | лакмус краснеет, метилоранж розовеет, фенолфталеин обесцвечивается |
| Взаимодействие с металлами вплоть до водорода | Mg+2HCl=MgCl2+H2 |
| Взаимодействие с основаниями и основными оксидами |
2KOH+H2SO4 (разбавленный)=K2SO4+2H2O CuO+H2SO4=CuSO4+H2O |
| Взаимодействие с солями | H2CO3+2HCl=2NaCl+H2O+CO2 |
Кислородные кислоты получают чаще всего при взаимодействии соответствующих оксидов с водой:
а бескислородные кислоты получают взаимодействием неметалла с водородом с последующим растворением полученного соединения в воде: H2+Br2=2HBr
Что мы узнали?
В 8 классе по химии даются общие сведения о кислотах вообще и их кислотно-основных свойствах.В статье приводятся краткие сведения о химических свойствах кислот, а также о физических свойствах этих веществ и способах их получения. Изученные химические элементы обладают рядом химических свойств, например, могут взаимодействовать с солями, оксидами и металлами.








Комментирование закрыто