
Карбоновые кислоты являются органическими кислотами. Они входят в состав живых организмов и участвуют в обмене веществ. Химические свойства карбоновых кислот определяются наличием карбоксильной группы -СООН. К ним относятся уксусная кислота, муравьиная кислота, щавелевая кислота, масляная кислота и ряд других кислот.
Общее описание
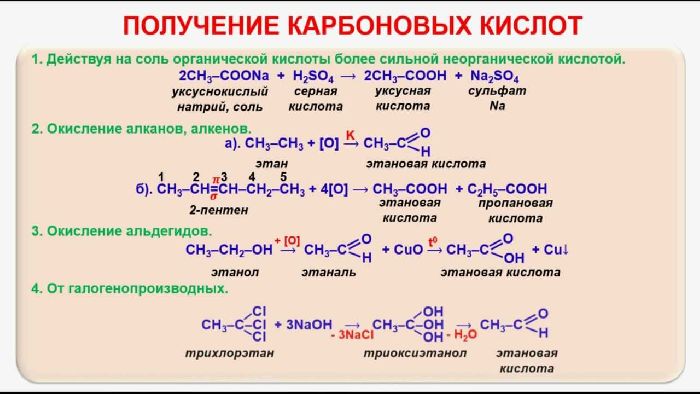
Существует несколько способов получения карбоновых кислот:
- окисление спиртов – C2H5OH + O2 → CH3COOH + H2O (из этанола образуется уксусная кислота);
- окисление альдегидов – CH3COH + [O] → CH3COOH;
- окисление бутана – 2C4H10 + 5O2 → 4CH3COOH + 2H2O;
- карбонилирование спирта – CH3 + CO → CH3COOH;
- разложение щавелевой кислоты с образованием муравьиной кислоты – C2H2O4 → HCOOH + CO2;
- взаимодействие солей с концентрированной серной кислотой – CH3COONa + H2SO4 → CH3COOH + NaHSO4.
Физические свойства карбоновых кислот:
- температура кипения выше, чем у соответствующих углеводородов и спиртов;
- хорошая растворимость в воде – растворяется в катионах водорода и анионах кислотного остатка (являются слабыми электролитами);
- увеличение числа атомов углерода уменьшает силу кислот.
Карбоновые кислоты имеют прочные водородные связи (прочнее, чем у спиртов), что обуславливается высоким положительным зарядом на атоме водорода в карбоксильной группе.
Взаимодействие
Карбоновые кислоты меняют цвет индикаторов. Лакмус и метилоранж краснеют.
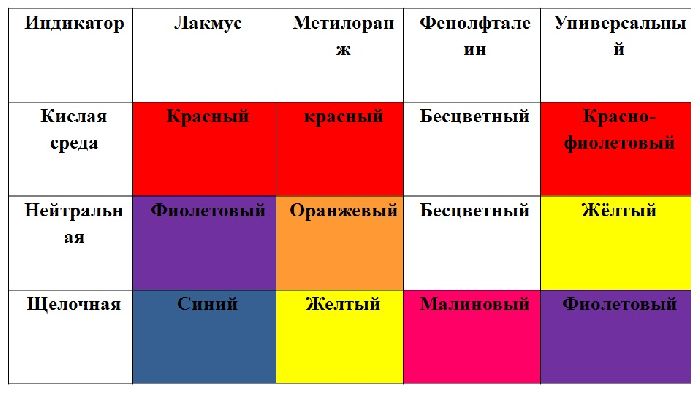
Таблица химических свойств карбоновых кислот описывает взаимодействие кислот с другими веществами.
|
Реакции |
Результат |
Пример |
|
С металлами |
Выделяется водород и образуются соли |
2CH3COOH + Mg → (CH3COO)2Mg + H2 |
|
С оксидами |
Образуются соль и вода |
2CH3COOH + ZnO → (CH3COO)2Zn + H2O |
|
С обоснованием (нейтрализацией) |
Образуются соль и вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С карбонатами |
Выделяется углекислый газ и вода |
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2 |
|
С солями слабых кислот |
Неорганическая кислота образуется |
2CH3COOH + Na2SiO3 → 2CH3COONa + H2SiO3 |
|
С аммиаком или гидроксидом аммония |
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода |
CH3COOH + NH3 → CH3COONH4 CH3COOH + NH4OH → CH3COONH4 + H2O |
|
Со спиртами (этерификация) |
Сложные эфиры образуются |
CH3COOH + C2H5OH → CH3COOC2H5 + H2O |
|
Галогенирование |
Соль образуется |
CH3COOH + Br2 → CH2BrCOOH |
Соли, образующиеся при взаимодействии веществ с муравьиной кислотой, называются формиатами, с уксусной кислотой – ацетатами.
Декарбоксилирование
Удаление карбоксильной группы называется декарбоксилированием, которое происходит в следующих случаях:
- при нагревании солей в присутствии твердых щелочей с образованием алканов — RCOONatsol + NaOHsol → RH + Na2CO3;
- при нагревании твердых солей – (CH3COO)2Ca → CH3-CO-CH3 + CaCO3;
- прокаливанием бензойной кислоты – Ph-COOH → PhH + CO2;
- при электролизе растворов солей – 2RCOONa + H2O → RR + 2CO2 + 2NaOH.
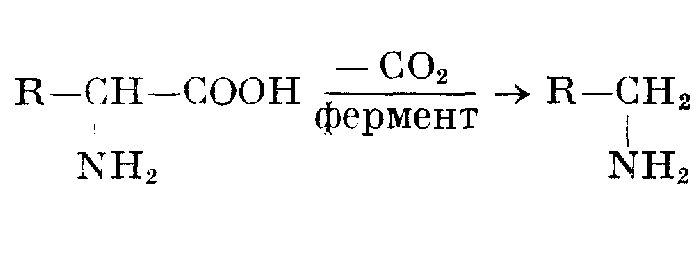
Что мы узнали?
На уроке 10 класса мы узнали об основных химических и физических свойствах карбоновых кислот. Они образуются при окислении спиртов, альдегидов, бутана, при карбонилировании, разложении и взаимодействии с серной кислотой. Кислоты хорошо растворимы в воде и кипят при более высоких температурах, чем спирты. При декарбоксилировании группа -СООН удаляется. Карбоновые кислоты взаимодействуют с солями, металлами, оксидами, гидроксидами, солями и аммиаком.








Комментирование закрыто