
Аминокислоты – сложные органические вещества, синтезирующие белок. Химический производственный яминой структуры представляет собой просто проводящую аминную (-NH2) и карбоксильную (-COOH) группы. Соединения амфотерны, проявляют свойства оснований и кислот.
Общее описание
Аминокислоты являются производными карбоновых кислот общей формулы NH2-R-COOH. R – углеводородный радикал, который может содержать и другие элементы. Чаще всего это сера или фосфор. Аминокислота может включать несколько аминогрупп.
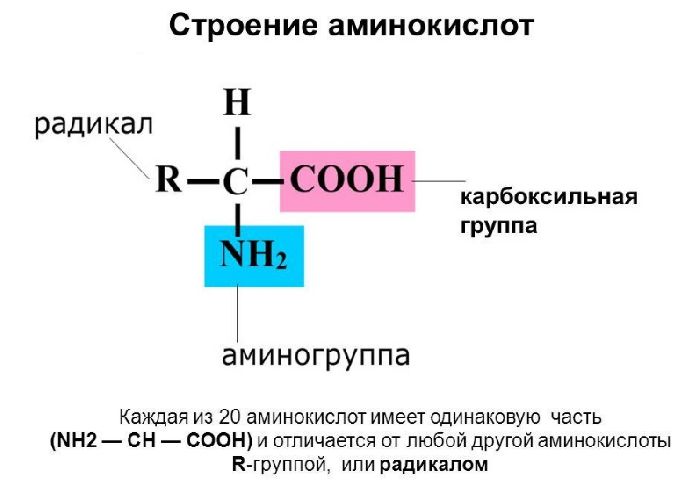
Соединения классифицируются по нескольким признакам. Основная классификация аминокислот представлена в таблице.
|
Признак |
Виды |
Описание |
|
О количестве радикалов между функциональными группами |
α-аминокислоты |
Один атом укробера между документами |
|
β-аминокислоты |
Два атома углерода между группами |
|
|
γ-аминокислоты и т.д. |
Три атома углерода между группами |
|
|
По строению радикала |
Алифатический |
Линейный или циклический без ароматических связей |
|
Ароматный |
Включают бензольное кольцо |
|
|
Гетероциклический |
Они содержат гетероатомы |
|
|
Иминокислоты |
Содержатель группы -NH |
|
|
По количеству функциональных групп |
Кислые |
Они включают две карбоксильные группы и одну аминогруппу |
|
Нейтральный |
Они содержат одинаковое количество карбоксильных и аминогрупп |
|
|
Базовый |
Они содержат несколько аминогрупп и одну карбоксильную группу |
|
|
По физическим свойствам |
Гидрофобный или неполярный |
Они не взаимодействуют с водой |
|
Гидрофильный или полярный |
Они взаимодействуют с водой |
|
|
О синтезе в организме |
Заменяемые |
Они синтезируются в организме |
|
Незаменимые |
Они поставляются в готовом виде вместе с едой |
|
|
Условно заменяемый |
Они образуют клетки, но в недостаточном количестве. Большая часть из них поставляется в готовом виде |

Названия аминокислот формируются из структурных или тривиальных наименований соответствующих кислот с приставкой «амино-». В начале названия указывается цифра, соответствующая номеру атома, у которого располагается аминогруппа. Нумерация атомов начинается от карбоксильной группы.
Свойства
Аминокислоты представляют собой кристаллические вещества с высокой температурой плавления и сладким вкусом. Аминокислоты хорошо растворимы в воде, но плохо растворимы в органических растворителях. При этом водные растовые аминоконины электропроводны.
Аминогруппа обуславливает основные свои аминой, карбоксильную группу – искусные свои. Следовательно, аминокислоты способны вступать в реакцию как с кислотами, так и с основаниями. Свойства аминокислот представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
С аммиаком |
Образуются амиды – производные карбоновых испарений |
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O |
|
С разтовром щелочи |
Образуются соли |
NH2CH2COOH + NaOH → NH2CH2COO-Na + H2O |
|
С раствором кислоты |
Образуются соли |
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4 |
|
Этерификация |
Сложные эфиры образуются |
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O |
|
Горящий |
При полном сгорании они разлагаются на углекислый газ, воду и азот |
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2 |
|
Разложение |
При плавлении выделяется углекислый газ |
NH2-CH2-COOH → NH2-CH3 + CO2↑ |
Из аминокислот состоят белки, выполняющие в организме различные функции.
Что мы узнали?
Аминокислота – кристаллическое сообщение, имеющее сложную структуру. Молекула вещества включает карбоксильную и аминогруппу. Поэтому вещество проявляет свойства оснований и кислот, вступая в реакции с кислотами, основаниями, этерифицируя. Аминокислоты разлагаются при нагревании и образуют амиды при реакции с аммиаком. При полном сгорании они разлагаются на углекислый газ, воду и азот.








Комментирование закрыто