
Гидролиз в самом широком смысле слова – это обменная реакция разложения между различными химическими веществами и водой. В чем суть гидролиза и какие реакции ионного обмена существуют?
Сущность гидролиза солей
Гидролиз соли – это обменное взаимодействие между солью и водой, приводящее к образованию слабого электролита. Возможность и характер гидролиза определяются природой основания и кислоты, из которых образуется соль.
Слово «гидролиз» происходит от двух греческих слов «вода» и «разложение»
С точки зрения электролитической диссоциации сущность гидролиза состоит в том, что ионы соли соединяются с ионами водорода или гидроксильными ионами воды (иногда с обоими одновременно). Если образуется слабый электролит, равновесие реакции ионного обмена в растворе смещается в сторону гидролиза. Нарушается равновесие в реакции электролитической диссоциации воды и изменяется характер среды раствора (появляется избыток ионов Н+ или ОН- по ионному произведению воды).
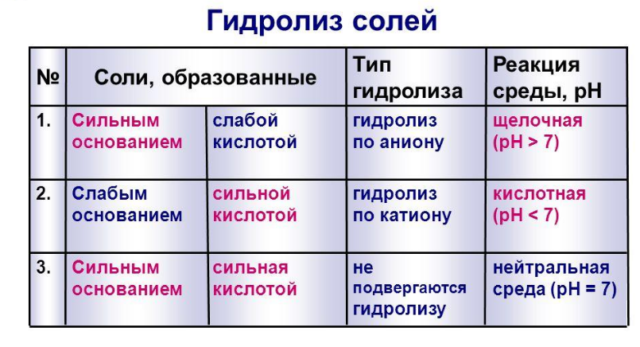
Реакции гидролиза солей
Если в результате взаимодействия с водой не образуется слабый электролит, реакция гидролиза просто не происходит. Это происходит, когда соль образуется из катиона сильного основания и аниона сильной кислоты (например, NaCl, K2SO4, NaNO3). Их водные растворы нейтральны (pH=7):
Во всех остальных случаях реакция гидролиза продолжается:
- соль образуется из катиона слабого основания и аниона сильной кислоты: например соли хлорида аммония NH4Cl, нитрата цинка Zn(NO3)2. Их водные растворы кислые (рН менее 7).
Пример гидролиза солей хлорида аммония:
NH4+Cl+H2O=NH4OH+H+Cl
NH4+H2O+NH4OH+H
NH4OH – слабый электролит

- соль образуется из катиона сильного основания и аниона слабой кислоты: например, соли ацетата натрия CH3COONa, карбоната натрия (соды) Na2CO3. Их водный раствор имеет щелочную реакцию (рН более 7), гидролиз происходит через анион соли, на первой стадии. Например, карбонат натрия Na2CO3 диссоциирует в водном растворе на ионы натрия и карбонат-ионы, затем карбонат-ионы реагируют с водой.
- наиболее полному гидролизу подвергаются хорошо растворимые соли, образовавшиеся из катиона слабого основания и аниона слабой кислоты: например, ацетат аммония CH3COONH4. В этом случае гидролиз протекает до конца как по аниону, так и по катиону, а природа среды практически нейтральна. Гидролиз ацетата аммония протекает по уравнению:
Раствор ацетата аммония практически нейтрален (pH=7), так как константы диссоциации уксусной кислоты и гидроксида аммония практически одинаковы
В рамках ионной теории Аррениуса механизм гидролиза объясняется следующим образом. Вода, хотя и в небольшой степени, диссоциирует на ионы H+ и OH-. Если в результате гидролиза образуется легко диссоциирующее основание, часть ионов ОН связывается, а такое же количество ионов Н+ оказывается свободным, вызывая кислую реакцию раствора. Напротив, если часть ионов Н+ в результате гидролиза связывается, то равное количество ионов ОН остается свободным, что и определяет щелочную среду раствора.

Что мы узнали?
В химии 11 класса подробно изучается предмет «Гидролиз солей». В данной статье дано определение гидролиза, а также пояснения, в каких случаях реакция гидролиза может протекать, а в каких реакции нет.








Комментирование закрыто