
Реакция разложения веществ водой называется гидролизом. Такому воздействию подвергаются неорганические и органические вещества – соли, углеводы, галогенированные алканы, белки, сложные эфиры. Процесс бывает обратимым и необратимым.
Неорганические вещества
Среди неорганических соединений гидролизу подвергаются растворимые минеральные соли за счет взаимодействия ионов с молекулами воды. В результате соль распадается на катионы и анионы, образуется электролит.
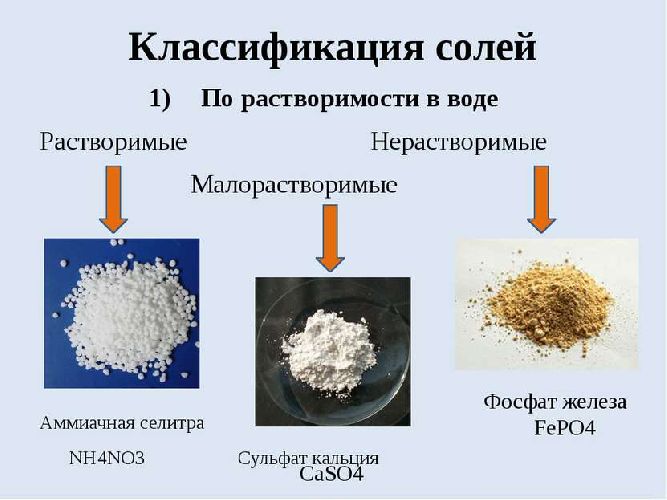
Соли могут образовываться:
- слабая кислота и сильное основание (Na2CO3);
- сильная кислота и слабое основание (ZnSO4);
- слабая кислота и слабое основание (Fe2(CO3)3);
- сильная кислота и сильное основание (Na2SO4).
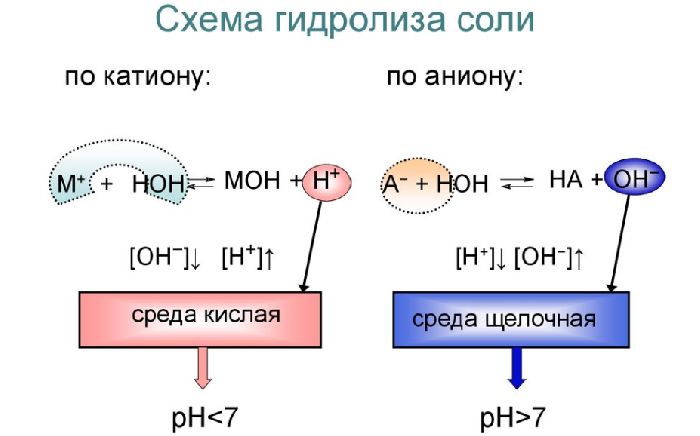
Ионы при твердых гидролизных годах образовывать с Н+ и ОН– слабыми электролитами. В зависимости от связи с ионами воды существуют реакции, протекающие по катиону или аниону, а также по катиону и аниону.
Соли, состоящие из сильной кислоты и сильного основания, не подвергаются гидролизу.
Описание процесса для разных солей представлено в таблице.
|
Гидролиз |
Сол |
Описание |
|
По аниону |
Слабая кислота, сильное основание |
Протекает ступенчато. Образуется слабощелочная среда. Обратимая реакция. Анионы солей связываются с катионами воды: 1. Na2CO3 + H2O ↔ NaHCO3 + NaOH; 2. NaHCO3 + HOH ↔ H2CO3 + NaOH |
|
По катиону |
Сильная кислота, слабое основание |
Оно протекает поэтапно, на втором и третьем этапах – незначительно. Образуется слабокислая среда. Обратимая реакция. Катионы солей связываются с анионами воды: NH4Cl + H2O ↔ NH4OH + HCl |
|
Об анионе и катионе |
Слабая кислота, слабое основание |
Утечка полностью. Смещение равновесия в сторону конечной продукции. Окружающая среда зависит от постоянной диссоциации. Реакция необратима: Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑ |
Обратимый процесс подчиняется принципу Ле Шателье: скорость реакции увеличивается при добавлении воды (разведении раствора) или повышении температуры.
Органические вещества
Вещества с высокой молекулярной массой подвергаются водному разложению. В результате гидролиза образуются мономеры или разрываются связи между углеродом и заместителями. Для реализации реакции необходимы дополнительные условия.
Краткая характеристика разложения под действием воды органических веществ приведена в таблице.
|
Вещество |
Описание |
Уравнение |
|
Галогеналканы |
Он протекает в щелочной среде. Духи образуются |
C5H11Cl + H2O (NaOH) → C5H11OH |
|
Комплексные трансляции |
Образуются угольные кислоты и спирты |
CH3COOCH3 + H2O ↔ CH3COOH + CH3OH |
|
Алкоголики |
Образуются спирт и щёлочь |
C2H5ONa + H2O ↔ C2H5OH + NaOH |
|
Углеводы |
Подвергаются олигосахариды и полисахариды. Моносахариды образуются |
C12H22O11 (сахароза) + H2O → C6H12O6 (глюкоза) + C6H12O6 (фруктоза) |
|
Белки |
Частично разлагаются. Аминокислоты образуются |
CH2(NH2)-CO-NH-CH2-COOH + H2O ↔ 2CH2(NH2)-COOH |
|
Жиры |
Подтекает при нагревании под действием кислот и щелочей. Образуются соли глицерина и угольной кислоты |
(C17H35COO)3C3H5 + H2O → C3H8O3 + 3C17H35COONa |
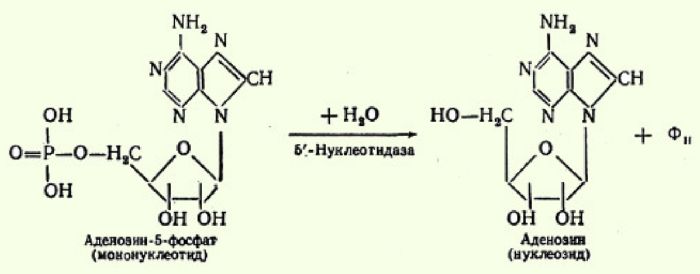
Нуклеиновые кислоты гидролизуются поэтапно. Изначально образуются нуклеотиды, которые также подвергаются гидролизу. Конечные продукты – моносахариды и ортофосфорная кислота
Что мы узнали?
Из темы урока химии класса 11 классли, что гидролиз – процесс разложения стривесть проекс проекси проесси проесси проесси процесс од объем воды. Реакции подвергаются соли, сложные эфиры, галогеналканы, спирты, белки, жиры, углеводы. Процесс часто происходит поэтапно. В зависимости от конечного продукта гидролиз протекает обратимый и необратимый. Ускорить взаимодействие веществ с водой и добиться полного разложения можно добавлением воды или повышением температуры.








Комментирование закрыто