
Электролиз – это процесс, при котором электрическая энергия превращается в химическую. Этот процесс происходит на электродах под действием постоянного тока. Что представляют собой продукты электролиза расплавов и растворов и что входит в понятие «электролиз».
Электролиз расплавов солей
Электролиз — окислительно-восстановительная реакция, происходящая на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
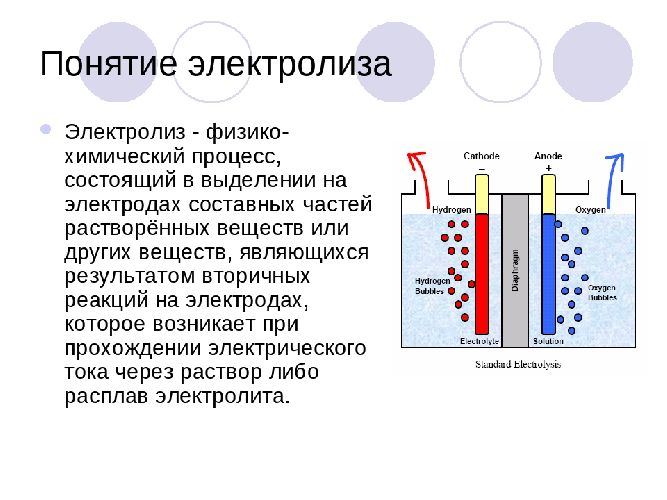
Хаотическое движение ионов под действием тока упорядочено. Анионы перемещаются к положительному электроду (аноду) и там окисляются, отдавая электроны. Катионы перемещаются к отрицательному полюсу (катоду) и там восстанавливаются, принимая электроны.
Электроды могут быть инертными (металлическими из платины или золота или неметаллическими из углерода или графита) или активными. Анод в этом случае растворяется в процессе электролиза (растворимый анод). Он изготовлен из таких металлов, как хром, никель, цинк, серебро, медь и т д.
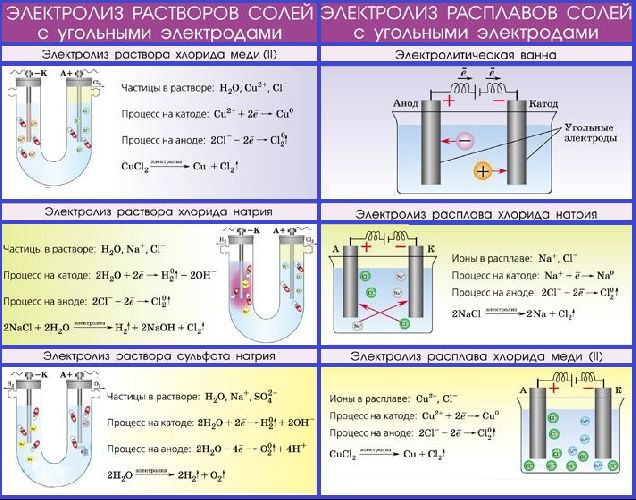
При электролизе расплавленных солей, щелочей и оксидов катионы металлов разряжаются на катоде с образованием простых веществ. Электролиз плавления — промышленный метод получения таких металлов, как натрий, калий, кальций (электролиз расплавленных солей) и алюминия (электролиз расплавленного оксида алюминия Al2O3 в криолите Na3AlF6, используемый для облегчения перехода оксида в расплав). Например, схема электролиза расплавленного хлорида натрия NaCl выглядит так:
Na+ + Cl–
Катод (–) (Na+): Na+ + e = Na0
Анод (–) (Cl–): Cl– – e = Cl0, 2Cl0 = Cl2
Итоговый процесс:
или
Одновременно с получением щелочного металла натрия при электролизе соли получают хлор.
Электролиз растворов солей
Если растворы солей подвергают электролизу, вода вместе с ионами, образующимися при диссоциации соли, также может окисляться или восстанавливаться на электродах.
В водных растворах существует определенная последовательность разряда ионов на электродах.
1. Чем выше стандартный электродный потенциал металла, тем легче его восстановить. Другими словами, чем правее металл находится в ряду электрохимических напряжений, тем легче ионы будут восстанавливаться на катоде. При электролизе растворов солей металлов от лития до алюминия включительно молекулы воды всегда восстанавливаются на катоде:
Если электролизу подвергнуть растворы солей металлов, начиная с меди и справа от меди, то на катоде восстанавливаются только катионы металлов. При электролизе солей металлов из марганца MN до свинца Pb возможно восстановление как катионов металлов, так и в некоторых случаях воды.
2. Анионы кислотных остатков (кроме F-) окисляются на аноде. Если соли кислородсодержащих кислот подвергаются электролизу, анионы кислотных остатков остаются в растворе, а вода окисляется:
3. Если анод растворимый, происходит окисление и растворение самого анода:
Пример: электролиз водного раствора сульфата натрия Na2SO4:

Так происходит электролиз, если катодное и анодное отделения разделены. Если их не разделить, происходит электролиз воды:
Электролиз используют для покрытия металла медью и золотом
Что мы узнали?
В 11 классе по химии предмет «Электролиз» является обязательным. Суть процесса состоит в том, что хаотическое движение ионов в электролите под действием электрического поля превращается в направленное.








Комментирование закрыто