
Процесс электролиза – это окислительно-восстановительная реакция, которая возможна только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях воду подвергают электролизу с получением чистых газов — водорода и кислорода.
Что такое электролиз
Для проведения процесса электролиза в раствор или расплав помещают два электрода, подключенные к противоположным полюсам источника тока. В качестве электродов чаще всего используют металл или графит, поскольку эти материалы передают электрический ток.
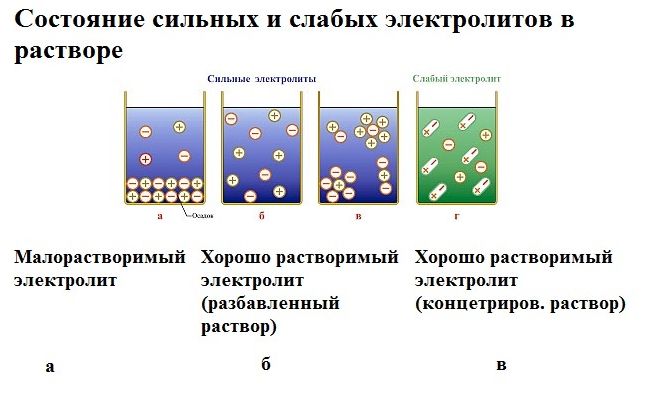
Под действием электричества электрод, соединенный с отрицательным полюсом, становится катодом, а электрод, соединенный с положительным полюсом, становится анодом. Катод и анод притягивают противоположные ионы: положительно заряженные катионы направлены к катоду, отрицательно заряженные анионы – к аноду.
Катод является окислителем; на нем происходит процесс восстановления катионов. На аноде происходит процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить электрический ток через воду, жидкость начнет диссоциировать на атомы, составляющие молекулу воды. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов могут образовываться озон и перекись водорода.
Схема электролиза воды:
- анод:
2H2O → O2 + 4H+ + 4e–;
- катод:
4H+ + 4e– → 2H2.
Или:
- анод:
3H2O → O3 + 6e- + 6H+;
- катод:
O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
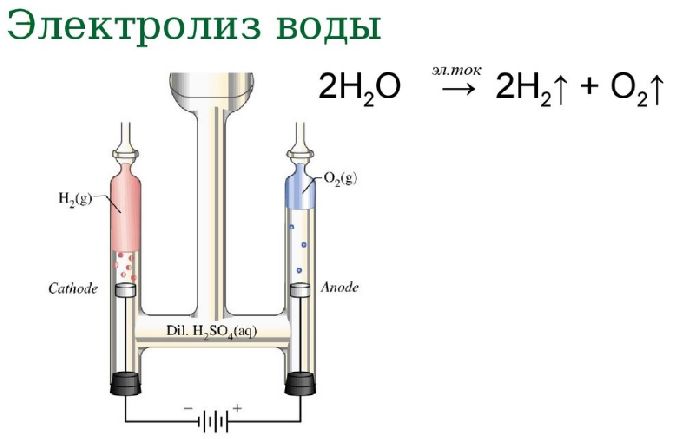
Вода является слабым электролитом, поэтому электролиз чистой дистиллированной воды протекает медленно или вообще не происходит. Чтобы ускорить процесс, в воду добавляют сильный электролит, повышающий проводимость электрического тока.
Электролит выбирают таким образом, чтобы исключить конкуренцию между катионами электролита и катионами воды (H+). В противном случае водород не будет производиться. Чтобы исключить конкуренцию, необходимо выбрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H+ по отношению к воде. На роль катиона электролита подходят:
- Ли+;
- Рб+;
- К+;
- Cs+;
- Ва2+;
- Ср2+;
- Са2+;
- Na+;
- Мг2+.
Чтобы исключить конкуренцию между анионами, наоборот, выбирают электролит с анионами с более высоким электродным потенциалом, чем у аниона ОН-вода. В качестве такого электролита для образования гидроксильного иона OH– используется щелочь–.
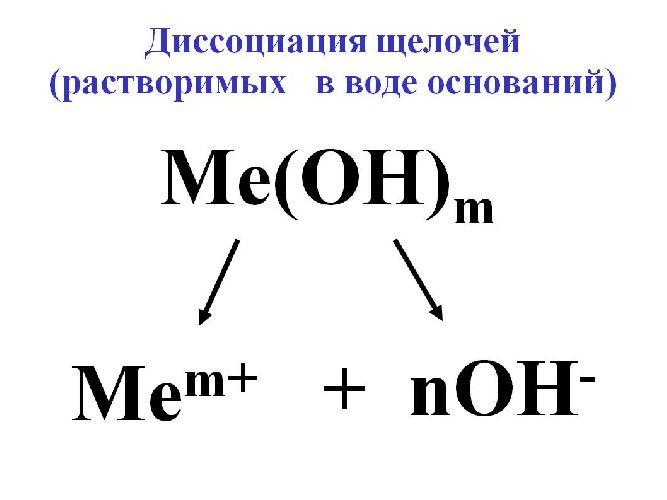
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – это процесс образования и осаждения ионов вещества на электродах под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциирует на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляют сильный электролит, не препятствующий образованию водорода и кислорода. Чаще всего добавляют щелочь или сильную кислоту.








Комментирование закрыто